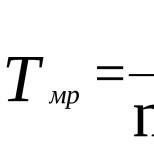Химическая промышленность и химические технологии презентация. Экскурсия «химия и производство». химическая промышленность химическая промышленность – это отрасль народного хозяйства, производящая продукцию на основе. Химическая промышленность и человек
Спички и соль. Соль вызывает зависимость. Смертельный исход. Соляной эталон. Осторожно, соль. «География» поваренной соли. Самое большое зеркало в мире. Стены гостиницы. Отели из соли. Соль или свобода. Остановится сердце. Назад в прошлое. Суд после смерти. Малиновое озеро. Смекалка и ловкость. Бруски соли. Поваренная соль. Соляной бунт. Интересные факты о поваренной соли.
«Гидролиз неорганических веществ» - Гидролиз соли СН3 СООNН4. Гидролиз карбидов. Гидролиз по аниону. Гидролиз соли. Условия смещения равновесия. Рефлексивная таблица. Гидролиз галогенидов. Разбор примера. Сущность гидролиза. Значение гидролиза солей. Определение реакции среды растворов солей универсальным индикатором. Алгоритм составления гидролиза солей. Теория электролитической диссоциации. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
«Кристаллическая решётка вещества» - Макет кристаллической решетки. Подведение итогов. Атомы. Твердые вещества. Кристалл. Шкала оценок. Возгонка. Закон постоянства состава веществ. Диктант. Кристаллические решетки. Познать сущее. Дайте характеристику аморфным веществам. Вещества с атомной кристаллической решеткой. Кристаллы серы. Агрегатное состояние веществ. Ответьте на вопросы. Кристаллическая решетка. Мотивация. Агрегатное состояние воды.
«Периодическая таблица Менделеева» - Молибден. Электронная конфигурация. Химический элемент. Вольфрам. Значение периодической системы. Борий. Заряд атома углерода. Формы электронных облаков. Орбитали. Отец будущего химика. Длинная форма таблицы. Появление периодической системы. Металлические свойства. Примеры графических формул. Короткая форма таблицы. Золото. Краткая электронная конфигурация. Периодическая таблица. Модель строения атома.
«Внеклассное мероприятие по химии» - Для чего применяют химические индикаторы. Цели мероприятия. Поставьте в соответствие название вещества с формулой. Закон сохранения масс. Придумайте четверостишия. Что можно доказать, используя данное оборудование. Химический лабиринт. Метанол. Получение газов. Петр Великий говорил: “Я предчувствую, что Россияне, когда–нибудь, а. Для чего предназначен прибор. Выдающийся естествоиспытатель древности Плиний Старший.
««Задачи» химия 11 класс» - Решение задач по нанохимии и нанотехнологии. Возможные структуры нанокластера. Объемная структура алмаза. Зависимость цвета золей золота (а) от размера частиц. Обнаружение метастаза. Структура нанопроволоки. Деление куба. Наночастица золота. Применение наноматериалов. Тепловой наномотор. Закрытые нанотрубки. Структура графенового монослоя. Два подхода к получению наночастиц. Образование одностенной трубки.











 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.










 Назад
Вперёд
Назад
Вперёд
Цели урока:
- Актуализировать и систематизировать знания о принципах химического производства.
- Повторить и углубить знания учащихся о химической промышленности.
- Развивать познавательную активность учеников, применяя нестандартные формы учебной деятельности.
Форма урока: Урок-игра “Ярмарка идей”
“Поставь перед собой сто учителей – они окажутся бессильны, если ты не можешь сам заставить себя и сам требовать от себя”.
В.А.Сухомлинский.
Эти слова Сухомлинского говорят нам о том, что человек получит знания только тогда, когда он сам этого захочет и сам их добудет.
Сегодня вам представится такая возможность.
Тема нашего урока: “Химия и производство”. В школьной программе мы рассматривали производство серной и азотной кислоты, силикатную промышленность, производство аммиака, метанола.
Сегодня мы подведём итог этим знаниям, откроем для себя новое производство, раскроем “секретную” лабораторию. По ходу урока вы будете зарабатывать баллы, которые затем будут переведены в отметку. “5” (20 – 30 баллов), “4” (10 -20 баллов), “3” (1 -10 баллов).
Ход урока
Разминка. Назовите формулу вещества.
1) Это вещество используется в медицине при обмороках.(3 балла)
Водный раствор аммиака. (2 балла)
Нашатырный спирт. NH 4 OH (1 балл)
2) Белое, твёрдое вещество не растворимое в воде. (3 балла)
Сырьё для получения извести. (2 балла)
Известняк, мел, мрамор. CaCO 3 (1 балл)
3)Кристаллы этого вещества вместе с полевым шпатом и слюдой составляют горную породу – гранит. (3 балла)
Это вещество называют кварцем, горным хрусталём. (2 балла)
Это вещество можно найти на берегу реки, на пляжах. (SiO 2) (1 балл)
Эти вещества тесно связаны с темой нашего урока “Химия и производство”. Так как сегодня нам предстоит повторить принципы промышленного производства некоторых веществ, в частности производство стекла, метанола, аммиака.
В начале урока мы познакомимся с некоторыми понятиями, касающимися нашей темы. Обобщение по теме подготовил ученик вашего класса Ульянов Алексей. (презентация).
Класс делится на 3 группы. Каждая группа получает кейс с набором учебного материала, который поможет вам вспомнить технологию получения заданного вещества. Ваша задача, используя данную информацию, ответить на заданный в кейсе вопрос. Первая группа получает информацию и задание на тему “Производство стекла”, вторая группа “Производство аммиака”, третья группа “Производство метанола”
Кейс №1.
(1 группа)
Производство стекла
Стекло – это твёрдый силикатный материал, основным свойством которого являются прозрачность и химическая стойкость.
Стекло получают варкой шихты (сырьевой смеси, состоящей из песка, соды и известняка) в специальных стекловаренных печах.
Иногда в стекло вводят вещества, способствующие его помутнению – “глушители”, например плавиковый шпат СаF2.сильно заглушенное стекло, оно белого цвета, называют молочным и используют прежде всего для изготовления светильников.
При добавлении оксида свинца получают хрустальное стекло. Оксид хрома окрашивает стекло в зелёный цвет, оксид кобальта в синий и т.д.
Задание: Используя данный материал, вспомните и запишите процессы производства стекла, заполнив таблицу:
Кейс №1.
(2 группа)
Производство аммиака
Сырьём для получения аммиака являются азот и водород. Источник азота – воздух, источник водорода – природный газ метан – СН 4 Исходную смесь газов берут в соотношении 1 объём N2 к трём объёмам Н2.
Реакция синтеза аммиака обратимая, экзотермическая, гомогенная. Реакцию проводят при температуре 450-500 0 с, используют катализатор – восстановленное железоFe с примесью оксида калия K 2 O и алюминия Al 2 O 3 .
Аммиак в дальнейшем используют для получения азотной кислоты, которая идёт на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большое количество аммиака расходуется на получение мочевины, являющейся прекрасным азотным удобрением.
Задание: Используя данный материал, вспомните и запишите процессы производства аммиака, заполнив таблицу:
Кейс №1.
(3 группа)
Производство метанола
В качестве сырья используют природный газ метан СН 4 . Реагирующие вещества: оксид углерода II СО и водород Н 2 . Их смесь называется синтез-газом. Синтез-газ получают действием водяных паров на газ метан при высокой температуре. Для синтеза метанола исходную смесь берут в соотношении 1 объём СО к 5 объёмам Н 2 . Реакция синтеза метанола обратимая, экзотермическая, гомогенная, идёт с уменьшением объёма. Реакцию проводят при температуре 370-400 0 с. Для ускорения синтеза используют катализатор ZnO Cr 2 O 3 .
Метанол используют для получения большого количества разных органических веществ, в частности формальдегида, который используется в производстве фенолформальдегидных смол и в производстве органического стекла. Кроме этого используется как добавка к бензину – повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
Задание: Используя данный материал, вспомните и запишите процессы производства метанола, заполнив таблицу:
Кейс №2.
Превращение целлюлозы в глюкозу.
Лабораторная работа
Цель работы: получение глюкозы из целлюлозы, обнаружение её с помощью медного купороса (гидроксида меди II.)
Закрепление знания учащихся в действиях, формирование организационных и практических умений.
Оборудование: фильтровальная бумага, вода, серная кислота (к), гранулы щёлочи, 2% медный купорос, пробирки, цилиндр.
Техника безопасности: работать с серной кислотой нужно осторожно (вливать кислоту тонкой струйкой), работать в специальных ящичках.
Ход работы
Фильтровальную бумагу разрываем на кусочки, помещаем в пробирку, заливаем 10 мл воды. Бумага в воде не растворяется.
Выливаем воду в колбу. В пробирке остаётся влажная фильтровальная бумага.
Добавляем в пробирку 1 мл концентрированной серной кислоты, происходит растворение кусков бумаги, и раствор приобретает тёмно-жёлтый оттенок. Реакция экзотермическая, смесь сильно разогревается.
Разбавляем полученную смесь водой (осторожно!). Получается прозрачный раствор. Образовалась глюкоза. Глюкоза имеет альдегидную группу, значит, возможна реакция с гидроксидом меди II.
Нейтрализация кислоты. Так как в пробирке сильно кислая среда, её нужно нейтрализовать (лучше твёрдой щёлочью). Для нейтрализации 1 мл серной кислоты лучше взять 15 гранул (это пол чайной ложки). Щёлочь следует добавлять постепенно, т.к. реакция экзотермическая, выделяется большое количество теплоты, раствор кипит. Признаком полной нейтрализации кислоты служит тёмно-жёлтое окрашивание раствора
К полученному раствору добавляем 2-3 мл 2% раствора медного купороса.
Сначала выпадает голубой осадок гидроксида меди II, который тут же в горячем растворе реагирует с продуктом гидролиза и превращается в оксид меди I , который выпадает в виде осадка (цвет от жёлтого до коричнево-красного зависит от условий).
Игра-расследование. Секретное производство.
Цель : Проверить усвоение учащимися знаний о способах получения и химических свойствах углеводородов.
Закрепить умения осуществлять органические превращения, распознавать органические вещества, основываясь на их химических свойствах.
Формировать коммуникативные, практические и интеллектуальные умения.
Ход игры
Класс делится на 3 группы (разведывательные лаборатории)
На территории военизированного и агрессивно настроенного государства действует секретное производство.
Задания для разведывательных лабораторий: (записаны на слайде)
1.Узнать какое вещество получают на секретном производстве, какова его структурная формула, название промежуточных продуктов, назначение в хозяйстве страны
2.Узнать принципиальную схему производства, записать соответствующие схемы реакций.
Схема реакций.

Лаборатории располагают только следующими данными: на производство в больших количествах доставляют вещество А, которое в первом цехе превращают в вещество В, во втором цехе из вещества В получают С, в третьем цехе получают вещество Х. Вещество Х вывозят на склады. Я готова вам продать информацию о производстве в виде подсказок за определённые баллы. Чем информативнее подсказка, тем легче она решается, тем она дешевле.
Подсказка А. (5 баллов)
Три жидких углеводорода с одинаковым числом атомов углерода в цепи устойчивы к окислению, в определённых условиях вступают в реакции замещения с галогенами и азотной кислотой. Один из этих углеводородов Е имеет линейное строение, углеводороды К и А – циклическое. С помощью реакции гидрирования и дегидрирования можно осуществить взаимопревращения этих углеводородов по схеме:

Подсказка А (4 балла).
При сгорании углеводорода образуется 4,4 г оксида углерода (IV) и 0,9 г воды. Плотность паров этого вещества по водороду равна 39. Определите молекулярную формулу этого вещества.
Подсказка А (3 балла).

Подсказка В (5 баллов).
Веществ В образовано действием на вещество А простым веществом, образованным элементом VII группы периодической системы, имеющим 45 нейтронов в ядре.
Подсказка В (4 балла).
Вещество В образуется при действии на него реагентом – единственно жидким неметаллом в присутствии собственной соли железа III.
Подсказка В (3 балла)
Вещество В имеет молярную массу157 г/моль, в его состав входят бензольное кольцо и один атом галогена.
Подсказка С (5 баллов).
Вещество С органическое, имеет сходство с одноатомными спиртами – взаимодействие с металлическим натрием.
Подсказка С (4 балла) .
Качественная реакция на вещество С – действие на вещество хлорида железа III.
Подсказка С (3 балла).
Вещество С образуется при взаимодействии вещества В со щёлочью.
Подсказка Х.(5 баллов).
Молекулярная формула вещества Х – С 6 Н 3 О 7 N 3
Подсказка Х (4 балла).
Вещество Х образуется в результате реакции нитрования вещества С.
Подсказка Х (3 балла).
В состав молекулы Х входят: одно бензольное кольцо, одна гидроксильная группа и три нитрогруппы.
Выводы: Дать название веществу. Использование вещества в промышленности.
(2,4,6 – тринитрофенол, используется как взрывчатое вещество.)
Химическая промышленность – отрасль тяжелой индустрии. Она расширяет сырьевую базу промышленности, строительства, является необходимым условием интенсификации сельского хозяйства (производство минеральных удобрений), удовлетворяет спрос населения на продукцию народного потребления. Структура химической промышленности постоянно усложняется и совершенствуется.
Химическая промышленность потребляет многие виды сырья: минеральное сырье (сера, фосфориты, соли) минеральное топливо (нефть, газ, уголь) растительное сырье (отходы лесной промышленности) воду и воздух производственные отходы предприятий металлургии и нефтепереработки (коксовый и сернистый газы) сельскохозяйственные отходы

Современные химические технологии дают возможность: Превращать в ценную промышленную продукцию неограниченный круг сырья Вовлекать в оборот по мере технологического прогресса новые виды сырья (природный газы с целью получения аммиака; попутные нефтяные газы для производства синтетического каучука) Заменять дорогое сырье (пищевые продукты) дешевым (древесным или минеральным) Комплексно использовать сырье (из нефти получать мазут, моторное топливо) Утилизировать производственные отходы (сернистые газы – получение серной кислоты, коксовые газы – получение аммиака) Производить одни и те же продукты из разных видов сырья (синтетический каучук из древесины, угля и газа) и, наоборот, получать разные химические продукты из одного и того же сырья (угль используется для производства аммиака, синтетических волокон.

Химическая промышленность состоит из следующих отраслей: 1) Химия полимеров (производство смол, пластмасс, синтетического каучука и химических волокон). 2) Переработка полимерных материалов (изготовление шин, резины, полиэтиленовой пленки). 3) Горно-химическая (добыча минерального сырья: апатиты, фосфориты, сера). 4) Производство синтетических красителей и химических веществ. 5) Химия органического синтеза (производство углеводородного сырья и полуфабрикатов для получения полимерных материалов). 6) Основная химия (получение кислот, щелочей, солей, минеральных удобрений).

Основная химия - это производство азотных, калийных удобрений, серной кислоты, соды. Россия занимает одно из первых мест в мире по запасам калийных солей. Основой производства азотных удобрений служит аммиак. Из аммиака производят селитру и карбомид. Весь аммиак производится из природного газа (дешевого сырья) поэтому предприятия по производству азотных удобрений размещаются в районах распространения газовых ресурсов (Северный Кавказ) и вдоль трасс магистральных газопроводов (Центр, Поволжье, Северо-Запад). Предприятия, работающие на коксе, находятся либо в угольных бассейнах (Берязники, Кемерово), либо в отдалении от них (Держинск, Москва), поскольку кокс может перевозиться на значительные расстояния. Если сырьем служит коксовый газ, то азотные производства тяготеют к центрам коксования угля или комбинируется с черной металлургией, где водород получается, как отход коксовых газов (Череповец, Липецк, Нижний Тагил).

Это главная отрасль нефтехимии (смолы, пластмассы, синтетический каучук, химические волокна). Производство пластмасс – из синтетических смол, из угля, попутных нефтяных газов, углеводородов нефтепереработки, частично из древесного сырья. Эта отрасль возникла в начале 20-х годов в Центральном районе: Москва, Владимир, Орехово-Зуево, Новомосковск (Тульская область) и постепенно распространилась на другие районы, районы, обеспеченные сырьевыми ресурсами: Санкт-Петербург, Дзержинск, Казань, Тюмень, Екатеринбург, Уфа и др.


Фосфатно-туковая промышленность ориентируется в основном на потребителя и на серную кислоту, в меньшей мере – на источники сырья. Основные запасы фосфатного сырья приходятся на европейскую часть. Из аппатитного концентрата производят почти все фосфатные удобрения в России. На Егоровском месторождении работает Воскресенский химкомбинат. Промышленные запасы фосфоритов имеются в Брянской области – Полтенское; в Кировской области – Верхнекамское; в Курской области – Шелровское, - но это сырье пригодно только для производства фосфоритной муки. Для производства фосфатных удобрений требуется большое количество серной кислоты, которую производят из привозного или местного сырья. Фосфатные удобрения производят некоторые центры черной металлургии (Череповец) и цветной металлургии (Красноуральск, Ревда, Владикавказ), где сырьем для серной кислоты служат производственные отходы, - например, сернистые газы.

Сода – техническое название карбонатов натрия. Гидрокарбонат – питьевая сода. Нормальный карбонат – кальцинированная сера. Каустическая сода – гидроокись натрия. Основным сырьем служит поваренная соль и известь. Имеются запасы естественной соды в Алтайском крае – Михайловское месторождение. Каустическая сода применяется в мыловаренной, стекольной, целлюлозно-бумажной, текстильной промышленности. В медицине и пищевой промышленности – питьевая сода. Центры: - Березники, Усольесибирское (Иркутская область).

Микробиологическая промышленность – новая отрасль, которая приобрела самостоятельное значение в 60-е годы. В настоящее время ее роль в промышленном производстве страны заметно возросла в связи с необходимостью интенсификации сельского хозяйства. Предприятия, использующие водородное сырье, ориентируется на центры нефтепереработки. Предприятия, ориентирующиеся на углеводородное сырье, размещаются соответственно в Поволжье, Волго-Вятском районе (Нижний Новгород).

Дзержинское Оргстекло - одна из крупнейших фирм по исследованиям, производству и продаже широкого спектра продуктов на акриловой основе. Капролактам - хлорорганические производства на базе привозной соли и этилена: производство хлора и каустической соды; производство продуктов хлорорганического синтеза: дихлорэтана, винилхлорида, поливинилхлорида, хлорэтила, монохлорамина; производства, связанные с переработкой поливинилхлорида (кабельные пластикаты, пленки, профили, линолеум и пр.) Корунд - состоит из нескольких производственно-технических комплексов, включающих в себя производства: сернистого ангидрида и сульфата аммония; труб из ПВХ; фосфорных солей; корундов синтетических; опытной химической продукции; лакокрасочной продукции. «Сибур-нефтихим» - продукция: бензол нефтяной, диэтиленгликоль, окись этилена, пропилен, этилен, э тиленгликоль «Синтез» - единственное в РФ производство этиловой жидкости; продукция: ацетон технический, железо карбонильное, пентакарбонил железа, перекись лития, ртуть, спирт изопропиловый, фенол.

Химическая промышленность играет большое значение в развитии страны. Она создаёт новые материалы, которых нет в природе. Химическая промышленность имеет неограниченную сырьевую базу: нефть, газ, древесина, вода, воздух и другие. Химические технологии очень разнообразны. Но не стоит забывать об экологии, ведь химическая промышленность является сильным загрязнителем окружающей среды.

Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Химия и производство
Решение технических, технологических и экономических проблем; Создание новых материалов с заранее заданными свойствами; Замена металла в строительстве, машиностроении; Повышение производительности и экономия затрат общественного труда; Помощь в научно-техническом прогрессе. Задачи
это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья. Ее основа – – наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. Химическая промышленность ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Научные принципы организации химических производств
Общие принципы Частные принципы 1. Создание оптимальных условий проведения химических реакций. Противоток веществ, прямоток веществ, увеличение площади поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентрации реагирующих веществ. 2. Полное и комплексное использование сырья. Циркуляция, создание смежных производств (по переработке отходов) 3. Использование теплоты химических реакций. Теплообмен, утилизация теплоты реакций 4. Принцип непрерывности. Механизация и автоматизация производства. 5. Защита окружающей среды и человека Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу.
Важнейшие составляющие химической промышленности
Производство Аппаратура Сырье Энергия Вода
Химическое сырье Вода Воздух Минеральное Рудное Нерудное Органическое Горючее Растительное Животное Железные руды Руды цветных металлов Руды редких металлов Поваренная соль Фосфориты, апатиты Калийные соли Серосодержащее сырье Песок Гипс, известняк Природные глины Каменный уголь Горючие сланцы Нефть Природный газ Древесина, хлопок Отходы с/х Шерсть, кожа Жиры, масла
кислот Производство
Серная кислота
СТЕКЛО, твердый аморфный прозрачный в той или иной области оптического диапазона (в зависимости от состава) материал, полученный при переохлаждении расплава, содержащего стеклообразующие компоненты (оксиды Si, B, Al, P и т. д.) и оксиды металлов (Li, K, Mg, Pb и т. д.). Наиболее распространено силикатное стекло. Стекло
ИСТОРИЯ ХУДОЖЕСТВЕННОГО СТЕКЛА Художественное стекло включает витражи, мозаики из смальты, архитектурные детали, художественные сосуды, светильники, скульптуру и композиции, украшения (бижутерию). Изделия из стекла изготовляют выдуванием, прессованием и отливкой. В основном используется силикатное стекло, но распространены и другие виды, например, фосфатное, с помощью которого имитируют дорогое богемское стекло.
Стекло Древнего Востока Родиной стекла считается Египет (4000 лет до н. э.), хотя при раскопках в Месопотамии находят фрагменты стеклянных изделий примерно на 500 лет и более ранние. Но именно в Египте, где изготавливались чаши, небольшие вазы, блюда, бусы, серьги, браслеты, печати, амулеты в основном зелено-бирюзовой гаммы, стеклоделие древнего мира достигло своего расцвета.
Стекло Греции Греческие мастера сделали следующий и очень важный шаг в развитии искусства стеклоделия: они нашли способ свободного выдувания стекла с помощью трубки. Греческие сосуды известны в основном во фрагментах. Редчайшие находки из Таврии (Крыма) хранятся в Эрмитаже.
Стекло в Средние века. Из Рима, примерно, к 6 веку н. э. центр изготовления высокохудожественных изделий из стекла переместился в Византию. Особенно процветало здесь изготовление смальты, а также непрозрачных цветных сосудов и флаконов для благовоний.
Стекло в России Первые данные об изготовлении стекла в домонгольской Руси были получены в конце 19 в. в результате раскопок под Овручем, на Украине, где обнаружили следы стекольного производства, осколки битых бус и браслетов.
Полиэтилен, полипропилен
Целлюлоза
Применение целлюлозы
Презентация о роли химии в развитии промышленности.
Просмотр содержимого документа
«Презентация "Химия в промышленности"»
Химия и производство
Выполнила:
Корпачева Лена

Химическая промышленность
- - это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья.

Основой химической промышленности является
Химическая технология – наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства

Научные принципы организации химических производств
1. Создание оптимальных условий проведения хим. реакций.
Противоток веществ, увеличение площади поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентраций реагирующих веществ.

2. Полное и комплексное использование сырья.
- Циркуляция, создание смежных производств (по переработки отходов)

3. Использование теплоты химических реакций.
Теплообмен, утилизация теплоты реакций

4. Принцип непрерывности
Механизация и автоматизация производства

5. Защита окружающей среды
Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу

-это природные материалы, используемые в промышленности для получения различных продуктов и ещё не прошедшие промышленной обработки.
По составу
Минеральное
Нерудное.
Органическое
Растительное,
животное

агрегатному
состоянию
Твёрдое
(руды,
топливо)
Газообраз
(газ,
воздух)


Использование воды в химической промышленности
- Сырьё
- Реагент
- Растворитель
- Катализатор
- Теплоноситель

Что бы сократить расход воды
- Широкое применение оборотного водоснабжения
- Замена водяного охлаждения воздушным
- Очистка сточных вод и их повторное использование

- Транспортировка сырья и готовой продукции
- Сжатие газов
- Дробление твёрдых веществ
- Контрольно – измерительное обслуживание

Элект
рическая
Тепловая
Световая
Хими
ческая
Ядерная