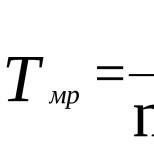Кто как может. Удельная теплота сгорания газообразного топлива и горючих газов
Энергоемкость топлив
Важнейшей характеристикой топлива является его энергоемкость, или теплота сгорания. Под энергоемкостью (или теплотой сгорания) следует понимать количество теплоты, выделившейся при полном сгорании единицы массы или объема топлива и замеренной при постоянных давлении и температуре (обычно при 25 °С).
В технике пользуются значением низшей теплоты сгорания 1 кг (весовой) или 1 л (объемной) топлива. Низшая теплота сгорания топлива (расчетная) получается уменьшением значения высшей теплоты сгорания (экспериментальной) на количество тепла, затраченного для испарения некоторых продуктов сгорания, которые при нормальной температуре являются жидкостями. В основном - это вода, которая выводится из двигателя с продуктами сгорания в парообразном состоянии. При этом исходят из того, что тепло образования водяных паров теряется безвозвратно.
В том случае, когда среди продуктов сгорания топлива не оказывается соединений, конденсирующихся при нормальной температуре, например при сжигании СО в СО 2 , высшая и низшая теплоты сгорания равны.
Для работы современных карбюраторных, дизельных и ракетных двигателей важно знать также теплоту сгорания рабочей смеси, состоящей из горючего и окислителя, в количестве, достаточном для полного сгорания горючего. При этом наибольшая теплота сгорания будет у рабочей.смеси, в которой стехиометрическое соотношение топливо: окислитель? равно 1.
Значение низшей теплоты сгорания рабочих смесей, состоящих из паров углеводородов с воздухом, приближается к 667- 674 ккал/кг.
Углеводородные топлива характеризуются высокой теплотой сгорания. Продуктами их полного сгорания являются, главным образом, двуокись углерода и вода. Лишь водород, бериллий и бор имеют большие теплоты сгорания, чем углеводороды. Однако при их использовании в качестве топлив возникают весьма сложные проблемы, которые здесь не рассматриваются. По эксплуатационным свойствам углеводороды как топлива отличаются значительными преимуществами.
Теплоту сгорания определяют сжиганием навески топлива в калориметрической бомбе, заполненной кислородом под давлением. Метод этот сложен, и для его осуществления требуются специальные условия.
Для определения теплоты сгорания при помощи расчетов широко пользуются эмпирическими формулами, точность которых составляет ±2-3%.
В основу эмпирических расчетных формул, составленных различными авторами, положены следующие данные.
1. Элементарный состав топлива. В этом случае исходят из того, что теплота сгорания топлива равна сумме теплот сгорания отдельных элементов его составляющих.
2. Количество кислорода (воздуха), необходимого для сгорания топлива. В основу эмпирических формул положено количество кислорода, необходимое для полного сгорания элементов, составляющих топливо. Наибольшей точностью из формул этого типа отличается формула Коновалова:
Q н = 3050 К
Где Q н - низшая теплота сгорания топлива, ккал/кг; К - количество кислорода, необходимого для сгорания единицы массы топлива, рассчитываемое по формуле:
где С, Н, О - содержание углерода, водорода и кислорода в топливе, вес. %.
3. Теплота образования. Эмпирические формулы основаны на законе Гесса, из которого следует, что теплота сгорания топлива соответствует разности между теплотой образования сжигаемого топлива и суммой теплот образования конечных продуктов его сгорания (воды, двуокиси углерода и др.).
4. Физико-химические характеристики топлива. Для углеводородных жидких топлив, состоящих в основном из двух элементов-углерода и водорода, устанавливается определенная зависимость между отношением этих элементов, температурой их выкипания, анилиновой точкой, плотностью, строением углеводородов и другими физико-химическими показателями, с одной стороны, и теплотой сгорания - с другой.
Для углеводородных топлив, имеющих плотность от 0,510 до 0,990, весовая теплота сгорания может быть определена с точностью до 3-5% (для фракций алканового основания до 1 - 1,5%) по формулам Крагоэ:

где?-плотность топлива при 15°С; Q в - высшая теплота сгорания, ккал/кг; О н - низшая теплота сгорания, ккал/кг.
Установлено, что при использовании этой формулы наименьшая погрешность составляет 40 ккал/кг; для смесси ароматических углеводородов с алканами наибольшая погрешность достигает 400-530 ккал/кг.
Лаврентьев предложил эмпирическую формулу для расчета низшей весовой теплоты сгорания по значению показателя преломления:
Для товарных реактивных топлив максимальное отклонение вычисленных данных, определенных экспериментально, составляет ±95 ккал/кг при среднем отклонении ±1,4 ккал/кг. Неудовлетворительные результаты получаются для узких нефтяных фракций, индивидуальных углеводородов, особенно ароматических углеводородов, для которых величина отклонения превосходит 400 ккал/кг.
Более точные результаты (отклонение ±20-25 ккал/кг), в том числе для ароматических углеводородов, дает формула, в которой используется показатель преломления и анилиновая точка:
где t A - анилиновая точка, °С.
Для среднедистиллятных нефтяных топлив можно достаточно точно рассчитать низшую весовую теплоту сгорания, зная содержание водорода, по формуле:
где Н - содержание водорода, вес. %.
Многие авторы считают, что наибольшая точность достигается при использовании расчетных формул, в которых представлена зависимость между теплотой сгорания, плотностью и анилиновой точкой среднедистиллятных топлив. Результаты расчета при использовании такой зависимости приняты во всех спецификациях США и других стран на реактивные топлива наравне со значениями, определенными экспериментально. Для керосинов отклонения от экспериментальных данных составляют 12- 14 ккал/кг, максимальные отклонения ± 45 ккал/кг. Небольшое содержание олефинов в керосинах существенно не влияет на результаты. Для алкилатов и индивидуальных углеводородов, кипящих в пределах керосиновых фракций, этот метод мало пригоден.
В спецификациях на реактивные топлива приводится коэффициент теплопроводности, представляющий собой произведение плотности, выраженной в °АРI (АSТМ D 287-55), и анилиновой точки в °F (АSТМ D 611-55Т), изменяющейся с теплотой сгорания топлива по линейной зависимости. В результате проверки этого метода на многочисленных образцах реактивных топлив нашей страны была предложена формула:
где К - коэффициент теплотворности топлива, численно равный произведению плотности топлива в °АРI и анилиновой точки в °F. Плотность определяется при 15,6 °С по ГОСТ 3900-47, а анилиновая точка - методом равных объемов (ОСТ 17872 М. И. 20К-40). Для получения плотности в °АРI, а анилиновой точки в °F пользуются переводными таблицами, приведенными в работах.
При использовании этой формулы можно получить результаты с точностью до 0,12% и максимальным отклонением 0,43% для нефтепродуктов плотностью? 5.16 15.6 =0,8448-0,7585 (36- 55°АРI), имеющих анилиновую точку 51-78,3 °С (124-173°F) и коэффициенты теплотворности в пределах от 4414 до 8969.
Некоторая ошибка получается при наличии в топливе серы. Так, при 1 % серы значение теплоты сгорания для керосина может быть завышено приблизительно на 60 ккал/кг. Поэтому для расчета низшей теплоты сгорания предлагается формула, учитывающая содержание серы:
где Q н -теплота сгорания топлива, содержащего серу, ккал/кг;
Q н - теплота сгорания, рассчитанная для топлива по анилиновой точке и плотности без учета содержания серы, ккал/кг; %S- содержание серы в топливе, вес. %.

Зная плотность? 15.6 15.6 и вязкость топлива (в сст) при 37,8 °С, по номограмме (рис. 18) можно определить анилиновую точку в °С, а затем перевести в °F. Отклонения для керосинов от данных, полученных стандартным методом, не превышают ± 2%.
Ниже приведены коэффициенты теплотворности и значения низшей весовой теплоты сгорания для различных реактивных топлив, рассчитанные по формуле.
Для упрощения расчетов предложены номограммы, составленные на основании зависимости между физико-химическими и энергетическими характеристиками нефтяных фракций. Ниже в качестве примера представлена одна из подобных номограмм,

построенная на основе зависимости между плотностью, молекулярным весом, псевдокритическим давлением, анилиновой точкой, средней температурой кипения, теплотой испарения и высшей теплотой сгорания для нефтяных фракций (рис. 19).

Зная две какие либо характеристики из названных, можно по номограмме определить остальные. При работе с номограммой среднюю температуру кипения фракции можно принять равной температуре выкипания 50 объемн. % этой фракции в условиях стандартной разгонки.
Поскольку на номограмме приведены значения высшей теплоты сгорания, значение низшей теплоты сгорания можно рассчитать по формуле:
где К - содержание в топливе воды, вес. %.
Отклонения данных, полученных по номограмме, от фактических данных составляют 1%.

На рис. 20 приведена номограмма зависимости между низшей объемной теплотой сгорания, плотностью, вязкостью и средней температурой выкипания дизельных топлив.
По такой номограмме при помощи известных характеристик можно легко определить объемную теплоту сгорания дизельных топлив.
Теплота сгорания зависит от элементарного состава углеводородов топлива, что подтверждается следующими данными:

Весовая теплота сгорания водорода в 3,5 раза больше весовой теплоты сгорания углерода. Чем выше содержание водорода, тем выше теплота сгорания углеводородного топлива.
Для алканов среднедистиллятных фракций содержание углерода изменяется незначительно - в пределах 84-85%, для цикланов эта величина постоянна и составляет приблизительно 85,75%, для ароматических углеводородов она изменяется в широких пределах - от 91 до 87,5% и зависит от длины боковых цепей.

Весовые теплоты сгорания топлива изменяются в соответствии с содержанием углерода: для алканов и цикланов незначительно, а для ароматических углеводородов с числом углеродных атомов от 6 до 20 - до 700 ккал (рис. 21). Плотность ? 4 20 углеводородов, составляющих товарные топлива и выкипающих в пределах 80-300°С, изменяется следующим образом :
Плотность в пределах одного класса углеводородов изменяется значительно. Она определяется не только молекулярным весом, но и структурой углеводородов. Вследствие этого объемные теплоты сгорания углеводородов существенно различаются.
Для углеводородов промышленных фракций, однотипных по строению и выкипающих в пределах 100-300°С, разница между максимальной и минимальной величинами весовой теплоты сгорания составляет от 30 до 350 ккал/кг, объемной- от 30 до 1100 ккол/л. Особенно велика разница объемной теплоты сгорания у цикланов - 700-1100 ккал/л (табл. 19).

Объемную теплоту сгорания можно значительно увеличить, одновременно сохраняя на достаточно высоком уровне весовую теплоту сгорания, вовлечением в состав топлив цикланов определенного строения.
Нефтяные топлива характеризуются теплотой сгорания, близкой к верхнему возможному пределу. Однако для дальнейшего увеличения теплоты сгорания углеводородных топлив остаются некоторые резервы. Все больше синтезируется, а также выделяется из нефти углеводородов такого строения, теплоты сгорания (весовые и объемные) которых существенно превышают теплоты сгорания товарных нефтяных фракций. На основе таких углеводородов предлагаются новые композиции высокоэнергетических топлив, столь необходимых для реактивных и ракетных двигателей.
Применение топлива с повышенной теплотой сгорания для карбюраторных и дизельных двигателей приведет к снижению его удельного расхода (поскольку теплота сгорания рабочей смеси должна быть постоянной); к уменьшению объема топливных баков при том же радиусе действия машин; к некоторому изменению сечения жиклеров в соответствии с количеством поступающего топлива. Мощность карбюраторных и дизельных двигателей не зависит от теплоты сгорания топлива и, следовательно, остается неизменной.
Для реактивных и ракетных двигателей, в которых сила тяги создается только за счет сил реакции газов, вытекающих из сопла, теплота сгорания топлива играет большую роль. Сила тяги воздушно-реактивного двигателя представляет равнодействующую сил воздушного и газового потоков, оказывающую влияние на элементы "Проточной части и наружной поверхности двигателя. Она прямо пропорциональна количеству воздуха, проходящего через реактивный двигатель, и скорости истечения газов через его сопло. Весовой расход топлива составляет 1,5-2% от весового расхода воздуха. Топливо, сгорая, нагревает воздух и тем самым увеличивает его кинетическую энергию, расходуемую на полезную работу и компенсацию потерь. Поэтому чем выше теплота сгорания топлива, тем большую полезную работу сможет дать двигатель.
Увеличение теплоты сгорания топлива приведет к увеличению объема газов, проходящих через двигатель, и, следовательно, к увеличению скорости их истечения, что повысит к. п. д. двигателя. Авиационные топлива, выделяющие при сгорании большее количество тепла, позволяют увеличить дальность полета или грузоподъемность самолета. О зависимости между энергоемкостью авиационного реактивного топлива и дальностью полета самолета можно судить по формуле Брегэ:

где К - дальность оолета; Q н - весовая низшая теплота сгорания топлива; ? - суммарный к. п. д. двигателя; L / D - отношение подъемной силы к лобовому сопротивлению; W 0 - вес самолета при старте; W f - вес залитого в баки самолета топлива.
Из приведенной формулы следует, что дальность полета самолета изменяется (прямо пропорционально теплоте, выделяющейся при сгорании топлива. Таким образом, при постоянном весе топлива повышение его весовой теплоты сгорания позволит в реактивном двигателе не только достичь преимуществ, указанных для карбюраторных двигателей, но и увеличить мощность двигателя, скорость м дальность полета самолета или уменьшить удельный расход топлива.
Увеличение объемной теплоты сгорания топлива, связанное с обязательным возрастанием его плотности, даст преимущества лишь в том случае, если прирост теплоты сгорания превзойдет потери энергии, которую необходимо будет дополнительно затратить вследствие увеличения полетного веса самолета, загруженного таким же объемом топлива, но имеющего большую плотность. Критерием энергетической оценки топлива будет являться удельная теплота сгорания загруженного топлива, отнесенная к единице полетного веса летательного аппарата.
Весьма желательно равенство значений весовой и объемной теплоты сгорания топлив; к такому равенству можно приблизиться, увеличивая плотность углеводородной смеси до единицы.
Выполнить это условие пока трудно, хотя методом синтеза удается получить насыщенные углеводороды, плотность которых превышает 0,9 г/см 3 .

На рис. 22 показано влияние теплоты сгорания и плотности топлива на дальность полета самолета при различных высотах. Как видно из рисунка, энергетические преимущества топлива с повышенной плотностью наиболее ощутимы при большой скорости полета (2,5-4 Маха).
При необходимости увеличения дальности полета топливо с большей весовой теплотой сгорания в сравнимых условиях будет обладать (преимуществом перед топливом с большей объемной теплотой сгорания (большей плотностью). На дальних расстояниях при использовании последних будет расходоваться дополнительная энергия на их перевозку.
Для ракетного двигателя значение топлива с высокой теплотой сгорания еще более возрастает. Высота взлета ракетного двигателя увеличивается во столько раз, во сколько увеличивается теплота сгорания топлива. Таким образом, при использовании для ракетных двигателей топлив с более высокой теплотой сгорания достигаются преимущества, указанные для воздушно-ракетных двигателей, и увеличивается высота взлета ракеты.
Исследователи стремятся получить такое углеводородное топливо, которое возможно полнее отвечало бы требованиям реактивных сверхзвуковых и тем более ракетных двигателей. Такие топлива должны характеризоваться высокой весовой и объемной теплотой сгорания при минимальном различии их значений. Кроме того, углеводороды, составляющие топлива, должны обладать удовлетворительными низкотемпературными свойствами, высокой химической стабильностью при повышенных температурах, пределами кипения и др. Предпринимаются попытки получения таких топлив не только на основе соответствующих нефтяных фракций и однотипных по химическому строению групп углеводородов, но и на основе сложного синтеза индивидуальных соединений, хотя этот путь намного дороже. В табл. 20 приведены сведения о некоторых синтезированных для этой цели в США индивидуальных углеводородах по данным патентной литературы, опубликованной в основном в 1964 г.

Как видно из данных табл. 20, осуществлен синтез углеводородов сложных и интересных структур. Исследование их свойств свидетельствует об известных возможностях, обнаруженных на этом пути. Большинство углеводородов являются би- и трицикланами с очень высокой плотностью, а следовательно, высокой объемной теплотой сгорания.
По-видимому, циклановые углеводороды в целом отвечают требованиям, предъявляемым к топливу, ;В большей мере, чем углеводороды иного строения. Можно предвидеть, что изоалка- новые углеводороды определенного строения также окажутся благоприятным материалом для этой цели.
Поскольку для реактивных топлив сверхзвуковых самолетов наиболее подходящим и доступным в настоящее время материалом являются циклановые углеводороды, характеризующиеся достаточно высокой весовой теплотой сгорания и плотностью, значения низшей весовой теплоты сгорания цикланов различного строения при 25°С (в ккал/кг).
Наряду с цикланами большое внимание заслуживают с точки зрения использования в качестве высокоэнергетических топлив изоалкановые углеводороды, характеризующиеся максимальным содержанием водорода, а следовательно, максимальной весовой теплотой сгорания. Сложность заключается в "Подборе таких структур изоалканов, низкотемпературная характеристика которых (температура застывания, кристаллизации, вязкость и ее изменение с температурой) была бы удовлетворительной, а плотность максимальной.
К числу таких углеводородов относятся, по-видимому, алканы гребенчатого строения с компактно и симметрично расположенными короткими боковыми цепями, имеющими один или два углеродных атома. Предстоит изыскать наиболее экономически целесообразный путь получения алканов," отвечающих такому строению.
Известна еще одна группа углеводородов, энергоемкость которых складывается не только из теплот сгорания элементов, но и из энергии, выделяющейся при разрушении их кратных связей и напряженных циклов. К ним относятся производные ацетилена и углеводороды, в структуре которых имеются циклопропановые кольца. Энергия ацетиленовой связи -С=С- составляет около

195 ккал/моль, т. е. более чем в два раза больше энергии связи (84 ккалімоль). Однако реализовать эту дополнительную энергию весьма сложно из-за склонности ацетиленовых углеводородов полимеризоваться по месту ненасыщенных связей. При сгорании циклопропана и его гомологов также выделяется дополнительная энергия, которая в отличие от энергии ацетиленовой связи может быть использована. В табл. 21 приведены теплоты образования и сгорания некоторых углеводородов с простыми и кратными связями, а также напряженными циклами.

Как видно из данных табл. 21, циклопропан и ацетиленовые углеводороды характеризуются весьма высокими теплотами сгорания, намного превышающими теплоты сгорания насыщенных углеводородов с таким же числом углеродных атомов в молекуле, но не имеющих столь напряженных связей. Наибольшую теплоту сгорания имеет циклопропан. Гомологи циклопропана характеризуются несколько меньшей теплотой сгорания. Так, низшая весовая теплота сгорания фенилциклопропана равна 10 280 ккал/кг, циклогексилциклопропана 10 610 ккал/кг. Гомологи циклопропана имеют следующие весьма важные преимущества по сравнению с ацетиленами: хорошую стабильность при хранении, низкотемпературные свойства, невзрываемость и др.
Очевидно, ди- и трициклопропаны будут представлять собой топлива, отличающиеся наибольшей энергоемкостью среди углеводородов иного строения, в том числе алканов.
В табл. 22 приводятся значения удельных импульсов для ракетных топливных систем при использовании в качестве горючего ацетилена или циклопропана.

Циклопропилуглеводороды могут быть получены в процессе довольно сложного синтеза, проходящего в несколько стадий. Ацетиленовые углеводороды могут быть получены в известных промышленных процессах.
В отличие от циклопропанов, которые являются довольно стабильными, ацетилены нуждаются в специальных стабилизирующих добавках и с ними надо обращаться, как со взрывчатыми веществами.
Таким образом, возможность получения углеводородов с более высокой энергоемкостью нельзя считать исчерпанной.
Всем известно, что в нашей жизни огромную роль играет использование топлива. Топливо применяют практически в любой отрасли современной промышленности. Особенно часто применяется топливо, полученное из нефти: бензин, керосин, соляр и другие. Также применяют горючие газы (метан и другие).
Откуда берется энергия у топлива
Известно, что молекулы состоят из атомов . Для того, чтобы разделить какую либо молекулу (например, молекулу воды) на составляющие её атомы, требуется затратить энергию (на преодоление сил притяжения атомов). Опыты показывают, что при соединении атомов в молекулу (это и происходит при сжигании топлива) энергия, напротив, выделяется.
Как известно, существует ещё и ядерное топливо, но мы не будем здесь говорить о нём.
При сгорании топлива выделяется энергия. Чаще всего это тепловая энергия . Опыты показывают, что количество выделившейся энергии прямо пропорционально количеству сгоревшего топлива.
Удельная теплота сгорания
Для расчёта этой энергии используют физическую величину, называемую удельная теплота сгорания топлива. Удельная теплота сгорания топлива показывает, какая энергия выделяется при сгорании единичной массы топлива.
Её обозначают латинской буквой q. В системе СИ единица измерения этой величины Дж/кг. Отметим, что каждое топливо имеет собственную удельную теплоту сгорания. Эта величина измерена практически для всех видов топлива и при решении задач определяется по таблицам.
Например, удельная теплота сгорания бензина 46 000 000 Дж/кг, керосина такая же, этилового спирта 27 000 000 Дж/кг. Нетрудно понять, что энергия, выделившаяся при сгорании топлива, равна произведению массы этого топлива и удельной теплоты сгорания топлива:
Рассмотрим примеры
Рассмотрим пример. 10 граммов этилового спирта сгорело в спиртовке за 10 минут. Найдите мощность спиртовки.
Решение. Найдём количество теплоты, выделившееся при сгорании спирта:
Q = q*m; Q = 27 000 000 Дж/кг * 10 г = 27 000 000 Дж/кг * 0,01 кг = 270 000 Дж.
Найдём мощность спиртовки:
N = Q / t = 270 000 Дж / 10 мин = 270 000 Дж / 600 с = 450 Вт.
Рассмотрим более сложный пример. Алюминиевую кастрюлю массой m1, заполненную водой массой m2, нагрели с помощью примуса от температуры t1 до температуры t2 (00С < t1 < t2
Решение.
Найдём количество теплоты, полученное алюминием:
Q1 = c1 * m1 * (t1 t2);
найдём количество теплоты, полученное водой:
Q2 = c2 * m2 * (t1 t2);
найдём количество теплоты, полученное кастрюлей с водой:
найдём количество теплоты, отданное сгоревшим бензином:
Q4 = Q3 / k * 100 = (Q1 + Q2) / k * 100 =
(c1 * m1 * (t1 t2) + c2 * m2 * (t1 t2)) / k * 100;
Недавно случившаяся авария ракеты« Днепр», космического носителя, переделанного из военной ракеты Р-36М УТТХ, снова вызвала интерес к ракетному топливу.

V-2 («Фау-2») легла в основу всей послевоенной ракетной техники, и американской, и советской

Запуск 900 ракет «Фау-2» требовал 12 тыс. т жидкого кислорода, 4 тыс. тонн этилового спирта, 2 тыс. т метанола, 500 т перекиси водорода и 1,5 тыс. т взрывчатки

Вместо спирта, который наряду с жидким кислородом использовал Вернер фон Браун, Королев для своих первых ракет выбрал керосин


Ни бензин, не керосин, ни дизельное топливо не воспламеняются сами при взаимодействии с кислотой, а для военных ракет самовоспламенение — одно из ключевых требований к топливу

Ракета S-4B, третья ступень еще одного детища Вернера фон Брауна — самой мощной американской ракеты-носителя Saturn V. В активе последней — 13 успешных запусков (с 1967 по 1973 год). Именно с ее помощью человек ступил на Луну
Жидкостные ракетные двигатели (ЖРД) — очень совершенные машины, и их характеристики на 90%, а то и больше, определяются примененным топливом. Эффективность же топлива зависит от состава и запасенной энергии. Идеальное топливо должно состоять из легких элементов — из самого начала таблицы Менделеева, дающих максимальную энергию при окислении. Но это не все требования к топливу — еще оно должно быть совместимым с конструкционными материалами, стабильным при хранении и по возможности недорогим. Но ракета — это не только двигатель, но еще и баки ограниченного объема: чтобы взять на борт больше топлива, его плотность должна быть повыше. Кроме топлива ракета везет с собой и окислитель.
Идеальный окислитель с точки зрения химии — жидкий кислород. Но одной химией ракета не исчерпывается, это конструкция, в которой все взаимоувязано. Вернер фон Браун выбрал для Фау-2 спирт и жидкий кислород, и дальность ракеты получилась 270 км. Но если бы ее двигатель работал на азотной кислоте и дизельном топливе, то дальность увеличилась бы на четверть, потому что такого топлива в те же баки помещается на две тонны больше!
Ракетное топливо — кладовая химической энергии в компактном виде. Топливо тем лучше, чем больше энергии запасает. Поэтому вещества, хорошие для ракетного топлива, всегда чрезвычайно химически активны, непрерывно пытаются высвободить скрытую энергию, разъедая, сжигая и разрушая все вокруг. Все ракетные окислители либо взрывоопасны, либо ядовиты, либо нестойки. Жидкий кислород — единственное исключение, и то только потому, что природа приучилась к 20% свободного кислорода в атмосфере. Но даже жидкий кислород требует уважения.
Хранить вечно
Баллистические ракеты Р-1, Р-2 и Р-5, созданные под руководством Сергея Королева, не только показали перспективность этого вида оружия, но и дали понять, что жидкий кислород не очень подходит для боевых ракет. Несмотря на то, что Р-5М была первой ракетой с ядерной боеголовкой, а в 1955 году даже было произведено реальное испытание с подрывом ядерного заряда, военных не устраивало, что ракету нужно заправлять непосредственно перед стартом. Требовалась замена жидкому кислороду, замена полноценная, такая, чтоб и в сибирские морозы не замерзала, и в каракумскую жару не выкипала: то есть с диапазоном температур от -55 градусов до +55 градусов Цельсия. Правда, с кипением в баках проблем не ожидалось, так как давление в баке повышенное, а при повышенном давлении и температура кипения больше. Но кислород ни при каком давлении не будет жидким при температуре выше критической, то есть -113 градусов Цельсия. А таких морозов даже в Антарктиде не бывает.
Азотная кислота HNO3 — другой очевидный окислитель для ЖРД, и ее использование в ракетной технике шло параллельно с жидким кислородом. Соли азотной кислоты — нитраты, особенно калийная селитра — уже много веков использовались как окислитель самого первого ракетного топлива — черного пороха.
Молекула азотной кислоты содержит как балласт лишь один атом азота да «половинку» молекулы воды, а два с половиной атома кислорода могут быть использованы для окисления горючего. Но азотная кислота — очень «хитрое» вещество, настолько странное, что непрерывно реагирует само с собой — атомы водорода от одной молекулы кислоты отщепляются и прицепляются к соседним, образуя непрочные, но чрезвычайно химически активные агрегаты. Из-за этого в азотной кислоте обязательно образуются разного рода примеси.
Кроме того, азотная кислота очевидно не удовлетворяет требованиям совместимости с конструкционными материалами — под нее специально приходится подбирать металл для баков, труб, камер ЖРД. Тем не менее «азотка» стала популярным окислителем еще в 1930-е годы — она дешева, производится в больших количествах, достаточно стабильна, чтобы ею можно было охлаждать камеру двигателя, пожаро- и взрывобезопасна. Плотность ее заметно больше, чем у жидкого кислорода, но главное ее достоинство по сравнению с жидким кислородом состоит в том, что она не выкипает, не требует теплоизоляции, может неограниченно долго храниться в подходящей таре. Только где ее взять, подходящую тару?
Все 1930-е и 1940-е годы прошли под знаменем поиска подходящих емкостей для азотной кислоты. Но даже самые стойкие сорта нержавеющей стали медленно разрушались концентрированной азоткой, в результате на дне бака образовывался густой зеленоватый «кисель», смесь солей металлов, который, конечно же, нельзя подавать в ракетный двигатель — он мгновенно забьется и взорвется.
Для уменьшения коррозионной активности азотной кислоты в нее стали добавлять различные вещества, пытаясь, зачастую методом проб и ошибок, найти комбинацию, которая бы, с одной стороны, не испортила окислитель, с другой — сделала его более удобным в использовании. Но удачная добавка была найдена только в конце 1950-х американскими химиками — оказалось, что всего 0,5% плавиковой (фтористоводородной) кислоты уменьшают скорость коррозии нержавеющей стали в десять раз! Советские химики задержались с этим открытием лет на десять-пятнадцать.
Секретные присадки
Тем не менее первый в СССР ракетный самолет-перехватчик БИ-1 использовал именно азотную кислоту и керосин. Баки и трубы пришлось делать из монель-металла — сплава никеля и меди. Этот сплав получался «естественным» образом из некоторых полиметаллических руд, поэтому был популярным конструкционным материалом второй трети ХХ века. О его внешнем виде можно судить по металлическим рублям — они сделаны из почти «ракетного» сплава. Во время войны не хватало, однако, не только меди с никелем, но и нержавеющей стали. Приходилось использовать обычную, покрытую для защиты хромом. Но тонкий слой быстро проедался кислотой, поэтому после каждого запуска двигателя остатки топливной смеси приходилось скребками удалять из камеры сгорания — техники поневоле вдыхали ядовитые испарения. Один из пионеров ракетной техники Борис Черток однажды едва не погиб при взрыве двигателя для БИ-1 на стенде, этот эпизод он описал в своей замечательной книге «Ракеты и люди».
Помимо добавок, снижающих агрессивность азотной кислоты, в нее пытались добавлять разные вещества, чтобы повысить ее эффективность как окислителя. Наиболее результативным веществом была двуокись азота, еще одно «странное» соединение. Обычно — газ бурого цвета, с резким неприятным запахом, но стоит его слегка охладить, он сжижается и две молекулы двуокиси склеиваются в одну. Поэтому соединение часто называют четырехокисью азота, или азотным тетраоксидом — АТ. При атмосферном давлении АТ кипит при комнатной температуре (+21 градус), а при -11 градусах замерзает. Чем ближе к точке замерзания, тем бледнее цвет соединения, становящегося под конец бледно-желтым, а в твердом состоянии — почти бесцветным. Это оттого, что газ состоит в основном из молекул NO2, жидкость — из смеси NO2 и димеров N2O4, а в твердом веществе остаются одни только бесцветные димеры.
Добавка АТ в азотную кислоту увеличивает эффективность окислителя сразу по многим причинам — АТ содержит меньше «балласта», связывает попадающую в окислитель воду, что уменьшает коррозионную активность кислоты. Самое интересное, что с растворением АТ в АК плотность раствора сначала растет и достигает максимума при 14% растворенного АТ. Именно этот вариант состава и выбрали американские ракетчики для своих боевых ракет. Наши же стремились повысить характеристики двигателей любой ценой, поэтому в окислителях АК-20 и АК-27 было по 20% и 27% соответственно растворенного азотного тетраоксида. Первый окислитель использовался в зенитных ракетах, а второй — в баллистических. КБ Янгеля создало ракету средней дальности Р-12, которая использовала АК-27 и специальный сорт керосина ТМ-185.
Зажигалки
Параллельно поискам лучшего окислителя шли поиски оптимального горючего. Военных больше всего устраивал бы продукт перегонки нефти, но и другие вещества, если они производились в достаточных количествах и стоили недорого, тоже можно было использовать. Проблема была одна — ни бензин, ни керосин, ни дизельное топливо не воспламеняются сами при контакте с азотной кислотой, а для военных ракет самовоспламенение — одно из ключевых требований к топливу. Хотя наша первая межконтинентальная ракета Р-7 использовала пару «керосин — жидкий кислород», стало ясно, что пиротехническое зажигание неудобно для боевых ракет. При подготовке ракеты к пуску требовалось вручную вставить в каждое сопло (а их у Р-7 ни много ни мало 32−20 основных камер и 12 рулевых) деревянную крестовину с зажигательной шашкой, подключить все электропровода, которыми шашки воспламеняются, и проделать еще много разных подготовительных операций.
В Р-12 эти недостатки были учтены, и зажигание обеспечивалось пусковым горючим, которое самовоспламенялось при контакте с азотной кислотой. Его состав был найден еще немецкими ракетчиками во время Второй мировой войны, и называлось оно «Тонка-250». Наши ракетчики переименовали его в соответствии с ГОСТами в ТГ-02. Теперь ракета могла стоять заправленной несколько недель, и это был большой успех, так как ее можно было бы запустить в течение пары часов вместо трех суток для Р-7. Но три компонента — много для боевой ракеты, а для использования в качестве основного горючего ТГ-02 годился только для зенитных ракет; для баллистических ракет дальнего действия нужно было что-то более эффективное.
Гиперголики
Химики назвали пары веществ, самовоспламеняющихся при контакте, «гиперголическими», то есть, в приблизительном переводе с греческого, имеющими чрезмерное сродство друг с другом. Они знали, что лучше всего воспламеняются с азотной кислотой вещества, имеющие в составе, кроме углерода и водорода, азот. Но «лучше» — это насколько?
Задержка самовоспламенения — ключевое свойство для пар химических веществ, которые мы хотим сжечь в ракетном двигателе. Представьте — включили подачу, горючее и окислитель накапливаются в камере, а воспламенения нет! Зато, когда оно наконец происходит, мощный взрыв разносит камеру ЖРД на кусочки. Для определения задержки самовоспламенения разные исследователи строили самые разные по сложности стенды — от двух пипеток, синхронно выдавливающих по капельке окислителя и горючего, до маленьких ракетных двигателей без сопла — форсуночная головка и короткая цилиндрическая труба. Все равно взрывы раздавались очень часто, действуя на нервы, выбивая стекла и повреждая датчики.
Очень быстро был обнаружен «идеальный гиперголь» — гидразин, старый знакомый химиков. Это вещество, имеющее формулу N2H4, по физическим свойствам очень похоже на воду — плотность на несколько процентов больше, температура замерзания +1,5 градуса, кипения +113 градусов, вязкость и все прочее — как у воды, но вот запах…
Гидразин был получен впервые в чистом виде в конце XIX века, а в составе ракетного топлива впервые употреблен немцами в 1933 году, но в качестве сравнительно небольшой добавки для самовоспламенения. Как самостоятельное горючее гидразин был дорог, производство его недостаточно, но, главное, военных не устраивала его температура замерзания — выше, чем у воды! Нужен был «гидразиновый антифриз», и его поиски шли непрерывно. Уж очень гидразин хорош! Вернер фон Браун для запуска первого спутника США «Эксплорер» заменил спирт в ракете «Редстоун» на «гидин» (Hydyne), смесь 60% гидразина и 40% спирта. Такое горючее улучшило энергетику первой ступени, но для достижения необходимых характеристик пришлось удлинить баки.
Гидразин, как и аммиак NH3, состоит только из азота и водорода. Но если при образовании аммиака из элементов энергия выделяется, то при образовании гидразина энергия поглощается — именно поэтому прямой синтез гидразина невозможен. Зато поглощенная при образовании энергия выделится потом при сгорании гидразина в ЖРД и пойдет на повышение удельного импульса — главного показателя совершенства двигателя. Пара кислород-керосин позволяет получить удельную тягу для двигателей первой ступени в районе 300 секунд. Замена жидкого кислорода на азотную кислоту ухудшает эту величину до 220 секунд. Такое ухудшение требует увеличения стартовой массы почти в два раза. Если же заменить керосин гидразином, большую часть этого ухудшения можно «отыграть». Но военным было нужно, чтобы горючее не замерзало, и они требовали альтернативу.
Пути разошлись
И тут пути наших и американских химиков разошлись! В СССР химики придумали способ получения несимметричного диметилгидразина, а американцы предпочли более простой процесс, в котором получался монометилгидразин. Обе эти жидкости, несмотря на их чрезвычайную ядовитость, устраивали и конструкторов, и военных. К аккуратности при обращении с опасными веществами ракетчикам было не привыкать, но все же новые вещества были настолько токсичными, что обычный противогаз не справлялся с очисткой воздуха от их паров! Нужно было либо использовать изолирующий противогаз, либо специальный патрон, который окислял токсичные пары до безопасного состояния. Зато метилированные производные гидразина были менее взрывоопасными, меньше впитывали водяные пары, были термически более стойкими. Но вот температура кипения и плотность по сравнению с гидразином понизились.
Поэтому поиски продолжались. Американцы одно время очень широко использовали «Аэрозин-50» — смесь гидразина и НДМГ, что было следствием изобретения технологического процесса, в котором они получались одновременно. Позднее этот способ был вытеснен более совершенными, но «Аэрозин-50» успел распространиться, и на нем летали и баллистические ракеты «Титан-2», и корабль «Аполлон». Ракета «Сатурн-5» разгоняла его к Луне на жидком водороде и кислороде, но собственный двигатель «Аполлона», которому нужно было включаться несколько раз в течение недельного полета, должен был использовать самовоспламеняющееся долгохранимое топливо.
Тепличные условия
Но дальше с баллистическими ракетами произошла удивительная метаморфоза — они спрятались в шахты, для защиты от первого удара противника. При этом уже не требовалось морозостойкости, так как в шахте воздух подогревался зимой и охлаждался летом! Топливо можно было подбирать, не учитывая его морозоустойчивости. И сразу же двигателисты отказались от азотной кислоты, перейдя на чистый азотный тетраоксид. Тот самый, что кипит при комнатной температуре! Ведь давление в баке повышенное, а при повышенном давлении и температура кипения нас беспокоит гораздо меньше. Зато теперь коррозия баков и трубопроводов уменьшилась настолько, что стало возможным хранить ракету заправленной на протяжении всего срока боевого дежурства! Первой ракетой, которая могла стоять заправленной 10 лет подряд, стала УР-100 конструкции КБ Челомея. Почти одновременно с ней появилась гораздо более тяжелая Р-36 фирмы Янгеля. Нынешний ее потомок, последняя модификация Р-36М2, кроме баков, мало имеет общего с первоначальной ракетой.
По энергетическим характеристикам пары «кислород — керосин» и «четырехокись азота — НДМГ» очень близки. Но первая пара хороша для космических ракет-носителей, а вторая — для МБР шахтного базирования. Для работы с такими ядовитыми веществами была разработана специальная технология — ампулизация ракеты после заправки. Смысл ее понятен из названия: все магистрали перекрываются необратимо, чтобы избежать даже малейших утечек. Впервые она была применена на ракетах для подводных лодок, которые тоже использовали такое топливо.
Твердое топливо
Американские же ракетчики для боевых ракет предпочли твердое топливо. Оно имело несколько худшие характеристики, зато ракета требовала гораздо меньше подготовительных операций при запуске. Наши тоже пытались использовать твердотопливные ракеты, но последнюю ступень все равно приходилось делать жидкостной, для того чтобы скомпенсировать разброс работы твердотопливных двигателей, которые невозможно регулировать так, как жидкостные. А позднее, когда появились ракеты с несколькими боеголовками, на последнюю жидкостную ступень легла задача «разведения» их по целям. Так что пара «АТ-НДМГ» без работы не осталась. Не остается и сейчас: на этом топливе работают двигатели космического корабля «Союз», Международной космической станции и многих других аппаратов.
Кероси́н (англ. kerosene от греч. κηρός - воск) - смеси углеводородов (от C 12 до C 15), выкипающие в интервале температур 150-250 °C, прозрачная, слегка маслянистая на ощупь, горючая жидкость, получаемая путём прямой перегонки или ректификации нефти.
Свойства и состав
Плотность 0,78-0,85 г/см³ (при 20 °C), вязкость 1,2-4,5 мм²/с (при 20 °C), температура вспышки 28-72 °C, теплота сгорания около 43 МДж/кг.
В зависимости от химического состава и способа переработки нефти, из которой получен керосин, в его состав входят:
предельные алифатические углеводороды (C n H 2n+2) - 20-60 %
нафтеновые углеводороды (С n H 2n) - 20-50 %
бициклические ароматические 5-25 %
непредельные углеводороды - до 2 %
примеси сернистых, азотистых или кислородных соединений.
Типичный состав углеводородов в топливах (в %)
|
Циклоалканы | ||||
Из таблицы видно, что в наибольших количествах в топливах содержатся алканы и циклоалканы. Количество аренов составляет 10 – 20%. как продукты прямой перегонки эти топлива практически не имеют в своем составе олеыиновых углеводородов. С точки зрения требований, предъявляемых к топливам данной категории, классы углеводов далеко не равнозначные. Рассмотрим их влияние на некоторые из эксплуатационных свойств топлив
Для определения в керосинах каждого из четырёх основных классов углеводородов применяют методы: сульфирование, определение анилиновых точек и йодных чисел
Теплота сгорания. Чем больше в топливе доля водорода, тем выше теплота сгорания. В этом отношении углеводородный состав прямогонных керосиновых фракций, из которых вырабатываются авиационные керосины, оказывается наиболее благоприятным. Более насыщенные водородом (алканы и циклоалканы) в них составляют до 80%.
Показатель теплоты сгорания топлива для реактивных двигателей имеет особо важное значение. Чем он выше, тем больше дальность полета самолетана одной заправке, т. е. тем большую работу он может выполнить. Но теплоту сгорания следует рассматривать исходя из двух условий: самолет имеет ограниченный объем топливных баков или для него ограничена масса топлива, которым он может быть заправлен, хотя объем баков имеет запас. В первом случае для дальности полета лучшем является топливо с высокими значениями плотности и объемной теплоты сгорания, которыми обладают фракции циклоалкановой основы. Во втором случае лучшим будет топливо с меньшей плотностью, но с большей весовой теплотой сгорания. Такие свойства характерны для алкановых углеводородов.
Содержание ареновых углеводородов. Арены, входящие в состав авиационных керосинов (алкилбензолы, нафталин и его гомологи) плохо горят. Теплота их сгорания на 11 – 12% ниже, чем у остальных углеводородов. Они способствуют образованию нагара на деталях двигателей, кристаллизуются при низких температурах и забивают топливные фильтры. Поэтому присутствие в данных топливах этого класса углеводородов нежелательно.
Показатели «высота некоптящего пламени» характеризует нагарообразующую способность топлива, которая является следствием плохого сгорания аренов. Нагар отлагается на форсунках и приводит к нарушению геометрии факела распыла и пламени сгорания топлива. А это опасно, так как возможен прогар стенок камеры сгорания и лопаток турбины.
Для определения высоты некоптящего пламени керосина существует несколько фитильных приборов. Простейший из них показаны на рисунке.
1 – резервуар; 2 - втулка для резервуара; 3 - камера; 4 - направляющая фитиля: 5 - шкала; 6 - вытяжная труб
Сущность анализа с помощью любого из этих приборов заключается в сжигании пробы топлива с постепенным увеличением длины пламени путем поднятия фитиля до появления фитиля до появления дыма. Затем пламя уменьшают до его исчезновения и в этот момент фиксируют высоту пламени по шкале замера. При содержании аренов а авиационных керосинах в пределах 10 – 22% она не должна быть менее 16 – 25 мм.
Температура начала кристаллизации и вязкости. Необходимость регламентации этого свойства объясняется эксплуатацией самолетов на больших высотах при минус 60°С и ниже. В Этих условиях есть опасность остановки двигателя из-за забивания топливных фильтров и топливопроводов кристаллами линейных алканов и растворимой воды. Вязкость обеспечивает смазывающие и распыливающие свойства топлива. Особенности влияния углеводородного состава на оба эти свойства аналогичны тем, которые рассматривались применительно к дизельным топливам.
Йодное число. Этот показатель контролируют в целях предотвращения смешения авиационных керосинов с химически не стабильными фракциями продуктов термического или каталитического крекинга
Содержание фактических смол, общей серы и кислотность относятся к числу эксплуатационных свойств топлива. Они характеризуют осмоленность и коррозионную активность топлива в момент их определения. Их зависимость от состава углеводородов и примесей минеральных кислот, а также методы определения этих свойств нам известны из лекций по бензинам и дизельным топливам.
Получение
Получается путём перегонки или ректификации нефти, а также вторичной переработкой нефти. При необходимости подвергается гидроочистке.
Ректификация
Ректификация (от лат. rectus - прямой и facio - делаю) - это процесс разделения бинарных или многокомпонентных смесей за счет противоточного массо- и теплообмена между паром и жидкостью. Ректификацию можно проводить периодически или непрерывно. Ректификацию проводят в башенных колонных аппаратах, снабженных контактными устройствами (тарелками или насадкой) ректификационных колоннах.
Ректификация- разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путем многократных испарения жидкости и конденсации паров. В этом основное отличие ректификации от дистилляции, при которой в результате однократного цикла частичное испарение – конденсация достигается лишь предварительное (грубое) разделение жидких смесей.
СТАДИИ ПЕРЕРАБОТКИ НЕФТИ И ГАЗА. Сырые нефть и газ должны пройти серию стадий в процессе их очистки и переработки, прежде чем они превратятся в окончательные продукты, применяемые в промышленности и быту. После подъема под действием давления газа или воды в полевой (промысловый) сепаратор природный газ и легкий природный бензин удаляются, а жидкая нефть сохраняется. Серия насосных станций подает нефть по трубопроводам в хранилища нефтеперерабатывающих предприятий. Там, путем термической обработки в ректификационных колоннах, происходит разделение на бензин, керосин, различные типы газойля, масляные дистилляты и тяжелые остатки, а затем их индивидуальная очистка.
Дистилляция
Дистилляция (лат. distillatio - стекание каплями) - перегонка, испарение жидкости с последующим охлаждением и конденсацией паров.
Простая дистилляция - частичное испарение кипящей жидкой смеси путём непрерывного отвода и конденсации образовавшихся паров в холодильнике. Полученный конденсат называется дистиллятом, а неиспарившаяся жидкость - кубовым остатком.
Фракционная дистилляция (или дробная перегонка) - разделение многокомпонентных жидких смесей на отличающиеся по составу части - фракции. Основана на различии в составах многокомпонентной жидкости и образующегося из неё пара. Осуществляется путём частичного испарения легколетучих компонентов исходной смеси и последующей их конденсации. Первые (низкотемпературные) фракции полученного конденсата обогащены низкокипящими компонентами, остаток жидкой смеси - высококипящими.
Устройство простейшего перегонного аппарата.

1 Нагревательный элемент 2 Перегонный куб 3 Отводная трубка или насадка Вюрца 4 Термометр 5 Холодильник 6 Подвод охлаждающей жидкости 7 Отвод охлаждающей жидкости 8 Приёмная колба 9 Отвод газа (в том числе с понижением давления) 10 Аллонж 11 Температура нагревателя 12 Скорость перемешивания 13 Нагреватель 14 Водяная (масляная, песочная и т. п.) баня 15 Мешалка или гранулы 16 Охлаждающая ванна
Гидроочистка нефтепродуктов
Гидроочистка - процесс химического превращения веществ под воздействием водорода при высоком давлении и температуре. Гидроочистка нефтяных фракций направлена на снижение содержания сернистых соединений в товарных нефтепродуктах. Побочно происходит насыщение непредельных углеводородов, снижение содержания смол, кислородсодержащих соединений, а также гидрокрекинг молекул углеводородов. Наиболее распространённый процесс нефтепереработки. Гидроочистке подвергаются следующие фракции нефти:
1. Бензиновые фракции (прямогонные и каталитического крекинга);
2. Керосиновые фракции;
3. Дизельное топливо;
4. Вакуумный газойль;
5. Моторные масла
Гидроочистка керосиновых фракций
Гидроочистка керосиновых фракций направлена на снижение содержания серы и смол в реактивном топливе. Сернистые соединения и смолы вызывают коррозию топливной аппаратуры летательных аппаратов и закокcовывают форсунки двигателей.
Качество топлива до и после гидроочистки:

Применение керосина
Керосин применяют как реактивное топливо, горючий компонент жидкого ракетного топлива, горючее при обжиге стеклянных и фарфоровых изделий, для бытовых нагревательных и осветительных приборов, в аппаратах для резки металлов, как растворитель (например для нанесения пестицидов), сырьё для нефтеперерабатывающей промышленности. Керосин может использоваться как заменитель зимнего и арктического дизтоплива для дизельных двигателей. Для многотопливных двигателей (на основе дизеля) возможно применение чистого керосина. Допускается добавление до 20 % керосина в летнее дизельное топливо для снижения температуры застывания, при этом не ухудшаются эксплуатационные характеристики. Применяется так же для промывки механизмов, для удаления ржавчины.
Основные виды керосина
ТС - авиационный керосин ;
КТ - керосин технический ;
КО - керосин осветительный.
Авиационный керосин
АВИАКЕРОСИН - смеси парафиновых (20-60%), нафтеновых (20-60%), ароматич. (18,5-22,0%) и непредельных (0,3-1,0%) углеводородов. используемые как топливо для самолетов и вертолетов с газотурбинными двигателями. авиакеросин получают в основном при прямой перегонке нефти (часто с последующим гидроочисткой или гидрированием). В качестве авиакеросин обычно применяют дистилляты, содержащие лигроиновые, керосиновые или газойлевые фракции, ограниченно - смеси широкого фракционного состава (пределы выкипания 60-230 °С), включающие бензиновые дистилляты.
Характеристики авиационных керосинов