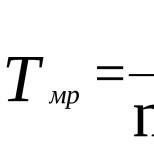Как определяют плотность газов при нормальных условиях. Скважинная добыча и подземное хранение газа. Законы Гей-Люссака и Шарля
Плотность газов – это масса вещества в единице объема – г/см 3 . Для практических целей используется относительная плотность газа по воздуху, т.е. отношение плотности газа к плотности воздуха. Иначе говоря – это показатель того, насколько газ легче или тяжелее воздуха:
где ρ в в стандартных условиях равно1,293 кг/м 3 ;
Относительная плотность метана – 0,554, этана – 1,05, пропана – 1,55. Вот почему бытовой газ (пропан) в случае утечки скапливается в подвальных помещениях домов, образуя там взрывоопасную смесь.
Взрывы могут развить важные ударные волны, которые обычно разрушают место, где они происходят. Также в случае утечки газа на открытом воздухе может произойти, что газ смешивается с воздухом в пропорции в пределах воспламеняемости. Если это произойдет, искра может вызвать локальный пожар. Это то, что называется дефлаграцией. В отличие от взрыва, взрывная волна мала, и почти нет разрушительных эффектов, если крупный пожар не появится позже, если поблизости обнаружены легковоспламеняющиеся вещества.
Дефлаграция обычно происходит на открытом воздухе, на тротуарах, улицах и т.д. и может быть вызвано разрывами распределительных сетевых труб. Ветер может перемещать газовое облако где-то дальше или в глубь соседнего жилища, где любая искра может начать огонь.
Теплота сгорания или теплотворная способность – количество тепла, которое выделяется при полном сгорании 1 м 3 газа. В среднем оно составляет 35160 кДж/м 3 (килоджоулей на 1 м 3).
Растворимость газа в нефти зависит от давления, температуры и состава нефти и газа. С ростом давления растворимость газа также возрастает. С ростом температуры растворимость газа снижается. Низкомолекулярные газы труднее растворяются в нефтях, чем более жирные.
Однако не всегда, где есть потеря газа в трубе, происходит дефлаграция. Также может случиться так, что накопленный газ быстро рассеивается в атмосферу и не воспламеняется. Во время промышленной революции конца восемнадцатого века уголь был основным основным источником энергии. Они сохраняют свою основную роль на энергетической сцене и в течение следующих 150 лет. Только в двадцатом веке нефтепродукты и природный газ постепенно смещали уголь из разных сфер промышленности. Сегодня площадь природного газа постоянно расширяется, несмотря на мрачные прогнозы его глобального истощения.
С повышением плотности нефти, т.е. по мере роста в ней содержания высокомолекулярных соединений растворимость газа в ней снижается.
Показателем растворимости газа в нефти является газовый фактор – Г, показывающий количество газа в 1 м 3 (или 1 т) дегазированной нефти. Он измеряется в м 3 /м 3 или м 3 /т.
По этому показателю залежи делятся на:
Основной причиной наложения природного газа в качестве источника энергии является его экологичность. В то время, когда общая тенденция развития мировой промышленности ориентирована на инвестиции в экологически чистые технологии производства, природный газ становится предпочтительным источником первичной энергии. Конечно, когда речь идет о глобальном газовом рынке, нельзя забывать о другой тенденции, которая является не только краткосрочным, но и долгосрочным аспектом, заключающимся в постоянном повышении его цены.
Широкое использование природного газа является причиной развития целой отрасли, охватывающей не только технологии добычи, хранения и транспортировки природного газа, но и для измерения параметров и количества энергетического ресурса. Исследования, проведенные в Германии, например, свидетельствуют о том, что если точность измерения количества природного газа возрастет всего на 1%, макроэкономические выгоды для отрасли будут составлять порядка миллионов евро.
1) нефтяные - Г
2) нефтяные с газовой шапкой – Г- 650 – 900 м 3 /м 3 ;
3) газоконденсатные - Г>900 м 3 /м 3 .
Растворимость воды в сжатом газе.
Вода растворяется в сжатом газе при высоком давлении. Это давление обусловливает возможность перемещения воды в недрах не только в жидкой, но и в газовой фазе, что обеспечивает ее большую подвижность и проницаемость через горные породы. С ростом минерализации воды растворимость ее в газе уменьшается.
Эта статья призвана предоставить вам систематический обзор основных методов, используемых для определения калорийности и плотности природного газа. Причиной этого является тот факт, что в последние годы природный газ все чаще используется как в промышленной, так и в бытовой сферах.
Требования к теплотворной способности топлива. Известно, что природный газ горит экологически безвредным для образования углекислого газа и воды. По определению термин теплота сгорания включает в себя всю энергию, которая выгружается во время процесса горения. Обычно для расчета естественной теплоты сгорания используются автоматические калориметры и хроматографы технологического газа. Этот тип измерительного прибора подлежит утверждению типа Государственным агентством по метрологии и техническому надзору.
Растворимость жидких углеводородов в сжатых газах.
Жидкие углеводороды хорошо растворяются в сжатых газах, создавая газоконденсатные смеси. Это создает возможность переноса (миграции) жидких углеводородов в газовой фазе, обеспечивая более легкий и быстрый процесс ее перемещения сквозь толщу горных пород.
С ростом давления и температуры растворимость жидких углеводородов в газе растет.
В принципе, максимально допустимая ошибка при определении теплотворной способности природного газа составляет 8%. Для обеспечения правильности измерений необходимо предусмотреть специально определенные условия для процесса измерения. Существуют также требования к установке и периодическим испытаниям калибровочных счетчиков калибровочного газа. Нормальный объем природного газа определяется для сравнения полученных результатов.
Следовательно, все параметры природного газа при расчете их объема производятся на основе так называемых нормальный объем, т.е. объем газа при определенных значениях температуры и давления. Независимо от их конструктивных различий, все калориметры работают по одному и тому же физическому принципу. Принципиальная схема конструкции калориметра показана на рис. Вообще говоря, строго определенное количество природного газа сжигается в камере сгорания калориметра. Тепло, выделяемое в процессе сжигания природного газа, передается через теплообменник на определенное количество теплоносителя, чаще всего воздух или газ.
Сжимаемость пластовых газов – это очень важное свойство природных газов . Объем газа в пластовых условиях на 2 порядка (т.е. примерно в 100 раз) меньше, чем объем его в стандартных условиях на поверхности земли. Это происходит потому, что газ имеет высокую степень сжимаемости при высоких давлениях и температурах.
Степень сжимаемости изображается через объемный коэффициент пластового газа, который представляет отношение объема газа в пластовых условиях к объему того же количества газа при атмосферных условиях.
Теплотворная способность топлива определяется изменением температуры хладагента. Или, точнее, между температурой хладагента и теплотворной способностью топлива существует прямая зависимость. Хотя принцип калориметрии не изменился с момента их создания, функциональные возможности современных приборов для измерения теплотворности топлива претерпели существенное развитие. Современная калориметрия является более точной с увеличением обработки, хранения и анализа измеренных значений и с еще большими возможностями связи.
Этот тип измерительного прибора используется для определения теплотворной способности газовых смесей на основе теплотворной способности отдельных компонентов смеси. Конечно, предпосылкой для изучения теплотворной способности газовых смесей с использованием газового хроматографа является предварительная информация об их составе. Газовый хроматограф является широко известным средством анализа газов среди метрологов. Он использовался десятилетиями в лабораторных исследованиях. Основным недостатком газовых хроматографов является их ручное обслуживание, которое ограничивает сферу их применения в функции теплотворной способности природного газа.
С явлениями сжимаемости газов и растворимости в них жидких углеводородов тесно связано конденсатообразование. В пластовых условиях с ростом давления жидкие компоненты переходят в газообразное состояние, образуя «газорастворенную нефть» или газоконденсат. При падении давления процесс идет в обратном направлении, т.е. происходит частичная конденсация газа (или пара) в жидкое состояние. Поэтому при добыче газа на поверхность извлекается также и конденсат.
С развитием технологической хроматографии на протяжении многих лет точное измерение теплотворной способности природного газа на основе этого принципа стало реальностью. Известно, что основным элементом конструкции газового хроматографа является разделительная колонна, заполненная гранулированным материалом. Отдельные компоненты газовых смесей проходят в течение различного периода времени расстояние от основания до верхней части разделительной колонны. Измеряя время, в течение которого отдельные вещества, входящие в состав газовой смеси , достигают датчика, установленного на выходе из разделительной колонны, измеряют количество веществ, участвующих в составе газовой смеси.
Конденсатный фактор – КФ – это количество сырого конденсата в см 3 , приходящегося на 1м3 отсепарированного газа.
Различают сырой и стабильный конденсат. Сырой конденсат представляет собой жидкую фазу, в которой растворены газообразные компоненты.
Стабильный конденсат получают из сырого путем его дегазации. Он состоит только из жидких углеводородов – пентана и высших.
На основе рассчитанных калорийности отдельных компонентов рассчитывается теплотворная способность газовой смеси. Методы определения плотности природного газа. Существует множество способов определения плотности природного газа. Среди наиболее широко используемых принципов определения плотности природного газа основано действие силы подъема. Эти средства измерения анализируют подъемную силу, действующую на тело строго определенного объема и плотности в газовой среде. Известно, что величина подъемной силы зависит от плотности газа.
В стандартных условиях газоконденсаты представляют собой бесцветные жидкости с плотностью 0,625 – 0,825 г/см 3 с температурой начала кипения от 24 0 С до 92 0 С. Большая часть фракций имеют температуру выкипания до 250 0 С.
- этан (C 2 H 6),
- пропан (C 3 H 8),
- бутан (C 4 H 10).
а также другие неуглеводородные вещества:
Для определения подъемной силы в промышленных применениях обычно используется индукционная катушка. Величина электрического тока, необходимого для компенсации движущей силы, действующей на тело в газовой среде, пропорциональна плотности газа. Измерительные приборы, работающие на основе описанного принципа, не подходят для определения плотности газовых потоков. Этот метод обеспечивает высокую точность определения плотности стационарного количества природного газа. Он в основном используется для измерения нормальной плотности.
Другой принцип определения плотности природного газа основан на возбуждении вибрационного процесса. Этот метод широко используется для определения плотности газовых потоков. В измерительной камере приборов установлен специальный элемент, работа которого основана на этом принципе. Он вибрирует с определенной, ранее известной частотой. Когда газ проходит через измерительную камеру, частота, с которой элемент мерцает, нарушается. Было обнаружено, что существует нелинейная зависимость между плотностью газового потока и смещением частоты вибрационного элемента.
Чистый природный газ не имеет цвета и запаха. Чтобы можно было определить утечку по запаху, в газ добавляют небольшое количество веществ, имеющих сильный неприятный запах (гнилой капусты, прелого сена) (т. н. одорантов). Чаще всего в качестве одоранта применяется этилмеркаптан (16г на 1000 куб.м.природного газа).
Существует методика для очень точного определения плотности потока газа, соответствующего каждому смещению частоты. Для расчета нормальной плотности газа используются два датчика вибрации. Первый датчик установлен в контрольной измерительной камере, заполненной строго определенным количеством природного газа. Вторая измерительная камера, в которой размещается другой датчик вибрации, заполняется пробным газом. Необходимым условием правильности измеренных результатов является то, что температура газа в двух камерах одинакова.
Плотность природного газа во второй камере оценивается по разности частот, с которыми два датчика вибрируют. Обоснованием для широкого использования такого прибора измерения плотности природного газа является высокая точность, с помощью которой можно измерить и дополнительно обработать частоту колебаний датчика вибрации.
Для облегчения транспортировки и хранения природного газа его сжижают, охлаждая при повышенном давлении.
Физические свойства
Ориентировочные физические характеристики (зависят от состава; при нормальных условиях , если не указано другое):
Третий принцип, основанный на использовании центробежного процесса, также применяется для определения плотности природного газа. Конструкция этого типа измерительного прибора содержит осесимметричную измерительную камеру, в которой установлен ротор с постоянной скоростью вращения. Анализируемый газ подается в смеситель в камере. В результате действия центробежной силы, создаваемой на молекулах газа при вращении смесителя, давление в камере увеличивается. Существует линейная зависимость между плотностью газа и увеличением давления в дозирующей камере.
- Плотность:
- от 0,68 до 0,85 кг/м³ относительно воздуха (сухой газообразный);
- 400 кг/м³ (жидкий).
- Температура самовозгорания: 650 °C;
- Взрывоопасные концентрации смеси газа с воздухом от 5 % до 15 %
- Удельная теплота сгорания: 28-46 МДж /м³ (6,7-11,0 Мкал /м³) ;
- Октановое число при использовании в двигателях внутреннего сгорания: 120-130.
- Легче воздуха в 1,8 раз, поэтому при утечке не собирается в низинах, а поднимается вверх
Природный газ, добываемый из недр земли, не имеет вкуса, цвета и запаха. Для придания запаха с целью распознавания его в воздухе в случае утечки используется одоризация - внесение в газ сильнопахнущего вещества. В качестве одоранта используется этилмеркаптан в количестве 16 г на 1 000 м3 природного газа. Это позволяет обнаружить природный газ при концентрации его в воздухе 1 %, что составляет 1/5 нижнего предела взрываемое™.
Описанный способ подходит для измерения плотности газовых потоков, но не отличается от высокой точности принципов, описанных выше. На чешских землях в Праге круглый год появилось новое транспортное средство, автомобиль с бензиновым двигателем. Использование газа в транспорте началось в Чешской Республике в течение года. В частности, использование сжиженного газа для управления автомобилями, автобусами и тракторами. В те годы газовые автобусы работали также в Крнов, Оломоуц, Млада-Болеслав.
В то время в Праге на заправочной станции в Михли была установлена компрессорная станция для наполнения бутылок сжатым газом. В нормальных атмосферных условиях пропан-бутан происходит в газообразной форме. Относительно легко, путем охлаждения или сжатия, его можно преобразовать в жидкое состояние. Легкий переход между двумя состояниями очень полезен для практического использования. Пропан-бутан в настоящее время является наиболее используемым газом на транспорте, поскольку автомобильное топливо используется на протяжении десятилетий.
Важнейшей теплотехнической характеристикой природного газа является теплота сгорания - количество теплоты, выделяющееся при сгорании 1 м3 сухого газа и зависящее от того, в каком агрегатном состоянии находится в продуктах горения вода, выделяющаяся из топлива и образующаяся при сгорании водорода и углеводородов, - в парообразном или жидком. Если в продуктах горения все водяные пары конденсируются и образуют жидкую фазу, то теплота сгорания называется высшей Q в с. Если же конденсации водяного пара не происходит, то теплоту сгорания называют низшей Q н c = 35,8.
Обычно продукты горения покидают котельные установки при температуре, при которой не происходит конденсации водяных паров, поэтому в теплотехнических расчетах используется величина Q н c , которая для природного газа близка к теплоте сгорания метана и составляет 35,8 МДж/м 3 (8 550 ккал/м 3).
Плотность природного газа (метана) при нормальных условиях (0°С и 0,1 МПа, т.е. 760 мм рт. ст.) рг = 0,73 кг/м 3 . Плотность воздуха при тех же условиях р в = 1,293 кг/м 3 . Таким образом, природный газ легче воздуха примерно в 1,8 раза. Поэтому при утечках газа он будет подниматься вверх и скапливаться у потолка, перекрытий, верхней части топки.
Температура самовоспламенения природного газа t воспл = 645... 700 °С. Это означает, что любая смесь газа с воздухом после нагревания до этой температуры воспламенится сама без источника зажигания и будет гореть.
Концентрационные границы воспламенения (взрыва) природного газа (метана) находятся в диапазоне 5... 15 %. Вне этих границ газовоздушная смесь не способна к распространению пламени. При взрыве давление в замкнутом объеме повышается до 0,8... 1 МПа.
К преимуществам природного газа по сравнению с другими видами топлива (в первую очередь с твердыми) относятся высокая теплота сгорания; относительно низкая стоимость; отсутствие складских помещений для хранения; относительно высокая экологичность, характеризующаяся отсутствием в продуктах горения твердых включений и меньшим количеством вредных газообразных выбросов; легкость автоматизации процесса сжигания; возможность повышения коэффициента полезного действия (КПД) котельного агрегата; облегчение труда обслуживающего персонала.
Плотность газов
Газы в отличие от жидкостей характеризуются малой плотностью. Нормальной плотностью газа называется масса одного его литра при 0°С и давлении 1 кгс/см2. Масса одной молекулы любого газа пропорциональна его плотности.
Плотность газа с изменяется пропорционально давлению и измеряется отношением массы газа m к занимаемому им объему V:
Для практических целей различные газы удобно характеризовать по их плотности относительно воздуха при одинаковых условиях давления и температуры. Поскольку молекулы разных газов имеют различную массу, их плотности при одинаковом давлении пропорциональны молярным массам.
Плотность газов и отношение их плотности к плотности воздуха:
Основные газовые законы
Характерным для газов является то, что они не имеют своего объема и формы, а принимают форму и занимают объем того сосуда, в который их помещают. Газы равномерно наполняют объем сосуда, стремясь расшириться и занять возможно больший объем. Все газы обладают большой сжимаемостью. Молекулы реальных газов обладают объемом и имеют силы взаимного притяжения, хотя эти величины весьма незначительны. В расчетах по реальным газам обычно используют газовые законы для идеальных газов. Идеальные газы - это условные газы, молекулы которых не имеют объема и не взаимодействуют друг с другом из-за отсутствия сил притяжения, а при столкновениях между ними не действуют никакие другие силы, кроме сил упругого удара. Эти газы строго следуют законам Бойля - Мариотта, Гей-Люссака и др.
Чем выше температура и меньше давление, тем поведение реальных газов ближе соответствует идеальным газам. При малых давлениях все газы можно рассматривать как идеальные. При давлениях около 100 кг/см2 отклонения реальных газов от законов идеальных газов не превышают 5 %. Поскольку отклонения реальных газов от законов, выведенных для идеальных газов, обычно ничтожны, законами для идеальных газов можно свободно пользоваться для решения многих практических задач.
Закон Бойля -- Мариотта
Измерения объема газа под влиянием внешнего давления показали, что между объемом V и давлением Р имеется простая связь, выражающаяся законом Бойля - Мариотта: давление данной массы (или количества) газа при постоянной температуре обратно пропорционально объему газа:
Р1: Р2 = V1: V2,
где Р1 - давление газа при объеме V1; Р2 - давление газа при объеме V2.
Отсюда следует,что:
Р1 * V1 = P2* V2 или Р * V= const (при t = const).
Этот постулат формулируется так: произведение давления данной массы газа на его объем постоянно, если температура не меняется (т.е. при изотермическом процессе).
Если, например, взять 8 л газа под давлением Р = 0,5 кгс/см2 и менять давление при неизменной постоянной температуре, то будут получены следующие данные: при 1 кгс/см2 газ займет объем 4 л, при 2 кгс/см2 - 2л, при 4 кгс/см2 - 1л; при 8 кгс/см2 - 0,5л.
Таким образом, при постоянной температуре всякое повышение давления приводит к уменьшению объема газа, а уменьшение объема газа - к повышению давления.
Зависимость между объемом газа и давлением при неизменной температуре широко применяется для различных расчетов в водолазной практике.
Законы Гей-Люссака и Шарля
Закон Гей-Люссака выражает зависимость объема и давления газа от температуры: при постоян-ном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
где Т1 и Т2 -- температура в Кельвинах (К), которая равна температуре в °С + 273,15; т.е. 0°С? 273 К; 100 °С - -373 К, а 0оК = -273,15 оС.
Следовательно, всякое повышение температуры приводит к увеличению объема, или, иными словами, изменение объема данной массы газа V прямо пропорционально изменению температуры t газа при постоянном давлении (т.е. при изобарическом процессе). Это положение выражается формулой:
где V1 - объем газа при данной температуре; V0 - исходный объем газа при 0°С; б -- коэффициент объемного расширения газа.
При нагревании различных газов на одинаковое число градусов относительное приращение объема одинаково для всех газов. Коэффициент б является постоянной для всех газов величиной приращения объема, равной 1/273 или 0,00367 оС-1. Этот коэффициент объёмного расширения газов показывает, на какую часть объема, занимаемого при 0°С, возрастает объем газа, если его нагреть на 1°С при постоянном давлении.
Соотношение между давлением и температурой подчиняется той же закономерности, а именно: изменение давления данной массы газа прямо пропорционально температуре при неизменном объеме (т.е. при изохорном процессе: от греческих слов «изос» -- равный и «хорема» -- вместимость), что выражается формулой:
Рt = Р0 (1 + бt),
где Рt -- давление газа при данной температуре; Р0 -- исходное давление газа при 0° С; б -- коэффициент объемного расширения газа.
Эта зависимость была установлена Ж.Шарлем за 25 лет до публикации Ж.Л.Гей-Люссака и нередко называется законом Шарля. Зависимость объема от температуры при постоянном давлении также была впервые установлена Шарлем.
При понижении температуры газа его давление убывает, а при температуре -273,15 °С давление любого газа равно нулю. Эта температура называется абсолютным нулем температуры. При этом прекращается хаотическое тепловое движение молекул и количество тепловой энергии становится равным нулю. Приведенные зависимости, выражающие законы Шарля и Гей-Люссака, позволяют решать важные практические задачи при подготовке и планировании подводных погружений, такие, например, как определение давления воздуха в баллонах при изменении температуры, соответствующие ему изменение запасов воздуха и времени пребывания на данной глубине и т. п.
Уравнение состояния идеального газа
Если зависимость между объемом, давлением и температурой связать воедино и выразить одним уравнением, то получается уравнение состояния идеального газа, которое объединяет законы Бойля - Мариотта и Гей-Люссака. Это уравнение впервые было выведено Б.П.Клайпероном путем преобразований уравнений, предложенных его предшественниками. Уравнение Клайперона состоит в том, что произведение давления газа данной массы на объем, деленное на абсолютную температуру, есть величина постоянная, не зависящая от состояния, в котором находится газ. Одна из форм написания этого уравнения:
В этом случае газовая постоянная r будет зависеть от природы газа. Если массой газа является моль (грамм-молекула), то газовая постоянная R является универсальной и не зависит от природы газа. Для массы газа, равной 1 молю, уравнение примет следующий вид:
Точное значение R cocтaвляeт 8,314510 Дж моль -1 К-1
Если брать не 1 моль, а любое количество газа, имеющего массу m, то состояние идеального газа можно выразить удобным для расчетов уравнением Менделеева -- Клайперона в том виде, в котором оно было впервые записано Д.И.Менделеевым в 1874 г.:
где m -- масса газа, г; М - молярная масса.
Уравнение состояния идеального газа может использоваться для расчетов в водолазной практике.
Пример. Определить, какой объем занимают 2,3 кг водорода при температуре + 10 °С и давлении 125 кгс/см2
где 2300 - масса газа, г; 0,082 - газовая постоянная; 283 - температура Т (273+10); 2 - молярная масса водорода М. Из уравнения следует, что давление, оказываемое газом на стенки сосуда, равно:
Это давление исчезает или при m > 0 (когда почти исчезает газ), или при V> ? (когда газ неограниченно расширяется), или при Т > 0 (когда молекулы газа не движутся).
Уравнение Ван-дер- Ваалъса
Еще М. В Ломоносов указывал на то, что закон Бойля - Мариотта не может быть верен при очень больших величинах давления, когда расстояния между молекулами сравнимы с их собственными размерами. Впоследствии полностью подтвердилось то, что отступления от поведения идеальных газов будут значительны при очень высоких давлениях и очень низких температурах. В этом случае уравнение идеального газа даст неверные результаты без учета сил взаимодействия молекул газа и занимаемого ими объема. Поэтому в 1873 г. Ян Дидерик Ван-дер-Ваальс предложил внести в это уравнение две поправки: на давление и на объем.
Закон Авогадро
Авогадро выдвинул гипотезу, по которой при одинаковых условиях температуры и давления все идеальные газы независимо от их химической природы содержат в единице объема равное число молекул. Отсюда следует, что масса равных объемов газа пропорциональна их молекулярной массе.
Исходя из закона Авогадро, зная объемы исследуемых газов, можно определить их массу и, наоборот, по массе газа узнать его объем.
Законы газовой динамики
Закон Дальтона. Давление смеси газов равно сумме парциальных (частичных) давлений отдельных газов, составляющих смесь, т. е. тех давлений, которые производил бы каждый газ в отдельности, если бы он был взят при той же температуре в объеме смеси.
Парциальное давление газа Pr пропорционально процентному содержанию С данного газа и величине абсолютного давления Рабс газовой смеси и определяется по формуле:
Pr = Pa6с С/100 ,
где Pr - парциальное давление газа в смеси, кг/см2; С - объемное содержание газа в смеси, %.
Проиллюстрировать данный закон можно, сравнив смесь газов в замкнутом объеме с набором гирь различного веса, положенных на весы. Очевидно, что каждая из гирь будет оказывать давление на чашу весов независимо от наличия на ней других гирь.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Российский государственный университет нефти и газа им. И.М.Губкина»
А.Н. Тимашев, Т.А. Беркунова, Э.А. Мамедов
ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ ГАЗА
Методические указания к выполнению лабораторных работ по дисциплинам «Технология эксплуатации газовых скважин» и «Разработка и эксплуатация газовых и газоконденсатных месторождений» для студентов специальностей:
РГ, РН, РБ, МБ, МО, ГР, ГИ, ГП, ГФ
Под редакцией профессора А.И. Ермолаева
Москва 2012
Определение плотности газа.
Методические указания к проведению лабораторных работ/ А.Н. Тимашев,
Т.А. Беркунова, Э.А. Мамедов – М.: РГУ нефти и газа имени И.М. Губкина, 2012.
Изложены способы лабораторного определения плотности газа. В основу положен действующий ГОСТ 17310 – 2002.
Методические указания предназначены для студентов нефтегазовых вузов специальностей: РГ, РН, РБ, МБ, МО, ГР, ГИ, ГП, ГФ.
Издание подготовлено на кафедре разработки и эксплуатации газовых и га-
зоконденсатных месторождений.
Печатается по решению учебно-методической комиссии факультета разра-
ботки нефтяных и газовых месторождений.
Введение………………………………………………………………. | ||
Основные определения………………………………………………. | ||
Плотность природного газа при атмосферном давлении………….. | ||
Относительная плотность газа………………………………………. | ||
Плотность природного газа при давлениях и температурах………. | ||
Лабораторные методы определения плотности природного газа…. | ||
Пикнометрический метод…………………………………………… | ||
Расчетные формулы………………………………………………….. | ||
Порядок определения плотности…………………………………… | ||
Расчет плотности газа………………………………………………… | ||
Определение плотности газа методом истечения………………….. | ||
Вывод соотношений для определения плотности исследуемого га- | ||
за……………………………………………………………………….. | ||
2.2.2. Порядок проведения работы…………………………………………. | ||
2.2.3. Обработка результатов измерений………………………………….. | ||
Контрольные вопросы……………………………………………….. | ||
Литература……………………………………………………………. | ||
Приложение А………………………………………………………… | ||
Приложение Б…………………………………………………………. | ||
Приложение В………………………………………………………… | ||
Введение
Физические свойства природных газов и углеводородных конденсатов ис-
пользуются как на стадии проектирования разработки и обустройства месторож-
дений природных газов, так и при анализе и контроле разработки месторождения,
работы системы сбора и подготовки продукции газовых и газоконденсатных скважин. Одним из главных физических свойств, подлежащих изучению, является плотность газа месторождений.
Поскольку состав газа месторождений природных газов является сложным,
состоящим из углеводородных (алканы, циклоалканы и арены) и неуглеводород-
ных компонентов (азот, гелий и др. редкоземельные газы, а также кислые компо-
ненты Н2 S и СО2 ), возникает необходимость лабораторного определения плотно-
сти газов.
В данном методическом указании рассмотрены расчетные способы опреде-
ления плотности газа по известному составу, а также два лабораторных метода определения плотности газа: пикнометрический и метод истечения через капил-
1. Основные определения
1.1. Плотность природного газа при атмосферном давлении
Плотность газа равна массе М , заключенной в единице объемаv вещест-
ва. Различают плотность газа при нормальных н Р 0,1013мПа ,Т 273К и
стандартных с Р 0,1013МПа ,Т 293К | в условиях, а также при любых дав- |
||||||||||
лении Р и температуреТ Р ,Т . | известной молекулярной массе | ||||||||||
плотность при нормальных условиях равна | |||||||||||
Кг /м 3 , | |||||||||||
при стандартных условиях | |||||||||||
кг / м3 , | |||||||||||
Где М – молекулярная масса газа, кг/кмоль; 22,41 и 24,04, м3 /кмоль – молярный объем газа соответственно при нормальных (0,1013 МПа, 273 К) и стандартных
(0,1013 МПа, 293 К) условиях.
Для природных газов, состоящих из углеводородных и неуглеводородных компонентов (кислых и инертных) кажущаяся молекулярная масса М к
определяется по формуле
i n i | |||||
Ì ê | êã/ êì î ëü, | ||||
где М i – молекулярная масса i-го компонента кг/кмоль;n i –мольный процент i-го компонента в смеси;
к – число компонентов в смеси (природном газе).
Плотность природного газа см равна
кг / м3 | при 0,1 МПа и 293 К | |||||||
Мк | кг / м3 | при 0,1 МПа и 293 К | ||||||
i – плотность i-го компонента при 0,1 МПа и 293 К.
Данные по индивидуальным компонентам приведены в таблице 1.
Пересчет плотности при различных условиях температуры и давлении
0,1013 МПа (101,325 кПа) в приложении В.
1.2. Относительная плотность газа
В практике инженерных расчетов часто используется понятие относитель-
ная плотность, равная отношению плотности газа к плотности воздуха при одинаковых значениях давления и температуры. Обычно принимают в качестве эталонных нормальные или стандартные условия, при этом плотность воздуха со-
ответственно составляет в 0 1,293кг /м 3 ив 20 1,205кг /м 3 . Тогда относитель-
ная плотность природного газа равна
1.3. Плотность природного газа при давлениях и температурах
Плотность газа для условий в продуктивном пласте, стволе скважины, газо-
проводах и аппаратах при соответствующих давлениях и температурах определя-
ется по следующей формуле
Р, Тсм | Р 293z 0 | кг / м3 , | |
z T 0,1013 | |||
где Р иТ давление и температура в месте расчета плотности газа; 293 К и 0,1013 МПа – стандартные условия при нахождениисм ;
z ,z 0 – коэффициенты сверхсжимаемости газа соответственно приР иТ и стан-
дартных условиях (значение z 0 = 1).
Наиболее простым способом определения коэффициента сверхсжимаемости z является графический метод. Зависимость z от приведенных параметров пред-
ставлена на рис. 1.
Для однокомпонентного газа (чистого газа) приведенные параметры опре-
деляются по формулам
и Т | |||||||||||
где Р с | и Т c – критические параметры газа. | ||||||||||
Для многокомпонентных (природных) газов предварительно рассчитывают- |
|||||||||||
ся псевдокритические давления и температуры по зависимостям | |||||||||||
Р nск | ni Pc i | ||||||||||
Т nскn iТ ci /100, | |||||||||||
где P c | и Т c – критические параметры i -го компонента газа. | ||||||||||
Так как состав природного газа определяется до бутана С4 Н10 | или гексана С6 Н14 |
||||||||||
включительно, а все остальные компоненты объединяются в остаток (псевдоком-
понент) С5+ или С7+ , в этом случае критические параметры определяются по фор-
Мс | |||||||||||
крс5 | |||||||||||
T крс5 | 353,5 22,35 М | ||||||||||
При 100 М с 5 240и700d с 5 950,
М с 5 – молекулярная масса С5+ (С7+ ) кг/кМоль;
d c 5 – плотность псевдокомпонента С5+ (С7+ ), кг/м3 .
Зависимость между М с | и d c | находится по формуле Крэга | |||
1030 М c | Кг /м 3 | ||||
М c 44,29 |
|||||
Таблица 1
Показатели компонентов природного газа
Показатели | Компоненты | |||||||||||||||||||||||||||||||||||
СН4 | С2 Н6 | С3 Н8 | iС4 Н10 | nС4 Н10 | iС5 Н12 | nС5 Н12 | Н2 S | CО2 | ||||||||||||||||||||||||||||
Молекулярная масса, | ||||||||||||||||||||||||||||||||||||
М кг/кмоль |
||||||||||||||||||||||||||||||||||||
Плотность, кг/м3 0,1 | ||||||||||||||||||||||||||||||||||||
Плотность, кг/м3 0,1 | ||||||||||||||||||||||||||||||||||||
Относительная плот- | ||||||||||||||||||||||||||||||||||||
Критический объем, | ||||||||||||||||||||||||||||||||||||
дм3 /кмоль |
||||||||||||||||||||||||||||||||||||
Критическое давление, | ||||||||||||||||||||||||||||||||||||
Критическая темпера- | ||||||||||||||||||||||||||||||||||||
Критическая сжимае- | ||||||||||||||||||||||||||||||||||||
мость, zкр |
||||||||||||||||||||||||||||||||||||
Ацентрический фактор | Рисунок 1 – Зависимость коэффициента сверхсжимаемости z от приведенных параметров Pпр и Тпр 2. Лабораторные методы определения плотности природного газа 2.1. Пикнометрический метод Пикнометрический метод установлен стандартом ГОСТ 17310-2002, в соот- ветствии с которым определяется плотность (относительная плотность) газов и газовых смесей. Сущность метода заключается во взвешивании стеклянного пикнометра объемом 100-200 см3 последовательно с осушенным воздухом и осушенным ис- следуемым газом при одинаковой температуре и давлении. Плотность сухого воздуха – величина эталонная. Зная внутренний объем пикнометра, можно определить плотность природного газа неизвестного состава (исследуемого газа). Для этого предварительно определяется внутренний объем пикнометра («водное число»), поочередно взвешивая пикнометр с осушенным воздухом и дистиллированной водой, плотности, которых известны. Затем взве- шивается пикнометр, заполненный исследуемым газом. Разность масс пикнометра с исследуемым газом и пикнометра с воздухом, поделенная на значение объема пикнометра («водное число») прибавляется к значению плотности сухого воздуха, что составляет в итоге плотность исследуемого газа. Вывод расчетных формул показан ниже. 2.1.1. Расчетные формулы Плотность природного газа пикнометрическим способом определяется на основе следующих соотношений:
г – плотность газа в условиях проведения замеров, г/дм3 кг ; вз – плотность воздуха в условиях проведения замеров, г/дм3 кг ; м 3 Мг – масса газа в пикнометре, г; Мвз – масса воздуха в пикнометре, г; | |||||||||||||||||||||||||||||||||||
На сегодняшний день газ, возникший естественным образом, служит важнейшим источником энергии. Все газообразные горючие соединения из недр земли не имеют запаха, содержат множество примесей, влияющих на плотность природного газа.
У таких газов отсутствует привычные для человека физические показатели - вкус, цвет, запах, - по которым мы способны определить их наличие. И все же им свойственны характерные показатели, такие как: плотность, температура горения, теплота сгорания, состав, предельная концентрация для возникновения взрыва, давление при взрыве.
В числе многих значимых физических показателей можно сказать про плотность природного газа. Это величина, которая рассчитывается как отношение массы к его объёму и расписывается формулой r = т/ V. Плотность природного газа при нормальных условиях находится в пределах от 0,73 до 0,85 кг/м3.
Особенности газа
Добытый из месторождений, он состоит из метана в диапазоне 82-98 % от всей массы, часто с примесями других углеводородов. в своём составе вмещает также и негорючие вещества: кислород, углекислота, азот, а также Сразу же после выкачки из недр газ освобождают от токсичного сероводорода, доведя его содержание к допустимому 0,02 г/м3. Наибольшую плотность природного газа создаёт содержание негорючих смесей N 2 , СО 2 , H 2 S или тяжёлых углеводородов. Наименьшие показатели дают сухие метановые среды. Общеизвестно, что увеличение показателя физической величины влечёт повышение температуры образования гидратов. Хотя и небольшой вес также способен давать гидраты. При высоком в залежи газ сжижается, а такое месторождение называют газоконденсатным.

В сравнении с другими видами топлива (твёрдые, жидкие) природный газ, плотность которого целиком зависит от его же состава, выгоден по нескольким показателям:
- дешевизна - как следствие гораздо более лёгкого способа добычи и транспортировки;
- при сгорании не образуются зола и твёрдые частички;
- относительно высокий показатель теплоты сгорания;
- нет нужды в предварительной подготовке голубого топлива к сжиганию;
- существенно облегчается труд обслуживающего персонала;
- значительно улучшаются санитарно-гигиенические условия работников;
- упрощаются условия автоматизации технических процессов.

В быту происходят случаи, когда давление газа на верхних этажах дома рискует оказаться больше, чем на нижних. Это объясняется тем, что показатель гораздо больше в сравнении с горючей средой. На высоте статическое сильно уменьшается, а давление газа уменьшается слабее.
Способы измерения плотности

Плотность природного газа определяют лабораторным путём. По причине технико-экономической целесообразности её допускается рассчитывать следующими способами:
- вручную;
- при помощи таблиц, графиков, диаграмм;
- с применением вычислительных машин и автоматизированных устройств.
Наиболее точный метод - помещение испытуемого образца в тонкостенный стеклянный баллон с дальнейшим взвешиванием на точных весах. Существуют также специальные приборы, измеряющие плотность природного газа. Это плотномеры самого разнообразного типа - вибрационные, пикнометрические, акустические, ареометрические, радиационные и другие. Среди них очень известны модели Solartron 7812 и Solartron 3098. Они способны обеспечивать непрерывное измерение в потоке. Как правило, эти модели используются в системах при коммерческом учёте газа.
Одной из важнейших физических свойств газообразных веществ является значение их плотности.
ОПРЕДЕЛЕНИЕ
Плотность - это скалярная физическая величина, которая определяется как отношение массы тела к занимаемому им объему.
Данную величину обычно обозначают греческой буквой r или латинскими D и d . Единицей измерения плотности в системе СИ принято считать кг/м 3 , а в СГС - г/см 3 . Плотность газа - справочная величина, её обычно измеряют при н. у.
Зачастую, применительно к газам используют понятие «относительная плотность». Данная величина представляет собой отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях - 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Относительная плотность газа
Обозначим относительную плотность газа m 1 / m 2 буквой D. Тогда
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
M(CO 2) = 2 × 22 = 44 г/моль.
Плотность газа в лабораторных условиях самостоятельно можно определить следующим образом: необходимо взять стеклянную колбу с краном и взвесить её на аналитических весах. Первоначальный вес - вес колбы, из которой откачали весь воздух, конечный - вес колбы, наполненной до конкретного давления исследуемым газом. Разность полученных масс следует разделить на объем колбы. Вычисленное значение и есть плотность газа в данных условиях.
p 1 /p N ×V 1 /m×m/V N = T 1 /T N ;
т.к. m/V 1 = r 1 и m/V N = r N , получаем, что
r N = r 1 ×p N /p 1 ×T 1 /T N .
В таблице ниже приведены значения плотностей некоторых газов.
Таблица 1. Плотность газов при нормальных условиях.
Примеры решения задач
ПРИМЕР 1
| Задание | Относительная плотность газа по водороду - 27. Массовая доля элемента водорода в нем - 18,5%, а элемента бора - 81,5%. Определите формулу газа. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим число атомов водорода в молекуле через «х», число атомов бора через «у». Найдем соответствующие относительные атомные массы элементов водорода и бора (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Ar(B) = 11; Ar(H) = 1. Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y = ω(H)/Ar(H) : ω (B)/Ar(B); x:y = 18,5/1: 81,5/11; x:y = 18,5: 7,41 = 2,5: 1 = 5: 2. Значит простейшая формула соединения водорода и бора имеет вид H 5 B 2 . Значение молярной массы газа можно определить при помощи его плотности по водороду: M gas = M(H 2) × D H2 (gas) ; M gas = 2 × 27 = 54 г/моль. Чтобы найти истинную формулу соединения водорода и бора найдем отношение полученных молярных масс: M gas / M(H 5 B 2) = 54 / 27 = 2. M(H 5 B 2) = 5 ×Ar(H) + 2 × Ar(B) = 5 ×1 + 2 × 11 = 5 + 22 = 27 г/моль. Это означает, что все индексы в формуле H 5 B 2 следует умножить на 2. Таким образом формула вещества будет иметь вид H 10 B 4 . |
| Ответ | Формула газа - H 10 B 4 |
ПРИМЕР 2
| Задание | Вычислите относительную плотность по воздуху углекислого газа CO 2 . |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух - это смесь газов. D air (CO 2) = M r (CO 2) / M r (air); D air (CO 2) = 44 / 29 = 1,52. M r (CO 2) = A r (C) + 2 ×A r (O) = 12 + 2 × 16 = 12 + 32 = 44. |
| Ответ | Относительная плотность по воздуху углекислого газа равна 1,52. |