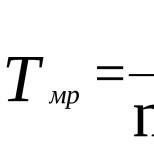Скачать презентацию на тему алканы. Презентация алканы. реакции замещения
Рассматривает возможность протекания реакций алканов, сопровождающихся отщеплением части молекулы. Как называются подобные реакции?
При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода. И могут образоваться углеводороды с меньшей молярной массой. Не только алканы, но и алкены. Этот процесс называется термическим крекингом (от англ. tocrack– «колоть, расщеплять»).
C 10H22---------C5H12+C5H10
C10H22---------C4H10+C6H12
В результате крекинга образуется смесь алканов и алкенов с меньшим количеством атомов углерода в молекулах, чем у исходного углеводорода. Чем выше температура крекинга, тем более легкие углеводороды образуются в результате.
В настоящее время в промышленности крекинг проводят чаще всего, используя катализаторы. В качестве катализаторов обычно применяют алюмосиликаты.
Каталитический крекинг протекает при более низких температурах, чем термический, и при этом происходит не только простое расщепление углеводородов, но и перестройка их углеродного скелета или изомеризация. В результате образуются углеводороды с более разветвлённым скелетом, чем исходные.
(каталитический крекинг – схема)
Это важно для повышения качества топлива. Каталитический крекинг углеводородов нефти – один из промышленных способов повышения октанового числа бензина. При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом.
При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется дегидрированием.
В результате этой реакции получаются непредельные углеводороды - алкены. Есть еще один важный процесс, при котором алканы, содержащие более 6 атомов углерода, нагревают над сложным катализатором. Этот катализатор обычно состоит из алюмосиликатов с добавкой платины. В результате отщепляется водород и образуются ароматические углеводороды – арены. Такой процесс называют риформингом
Его, так же, как и крекинг, используют в промышленности для получения бензина с высоким октановым числом.
Есть еще важная для промышленности реакция алканов – конверсия.
СН4+Н2O CO+3H2
Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами воды. При высокой температуре около 1000 образуется смесь оксида углерода – угарного газа и водорода. Эту смесь называют синтез газ. Часто ее не разделяют, а используют для получения разных органических веществ.








Алгоритм составления названий органических соединений Выбирают наиболее длинную (главную) цепь и нумеруют ее ближе к тому концу, к которому стоит радикал (заместитель, обозначен желтым цветом) (3) (4) (5) (6) (7) СН 3 – СН – СН 2 – СН 2 – СН 2 – СН – СН 2 – СН 3 ! ! (2) СН 2 СН 2 – СН 2 – СН 3 ! (8) (9) (10) (1) СН 3 Данное вещество называется: 3-метил, 7-этилдекан

2. Название строится в следующей последовательности: А) ПРЕФИКС: состоит из цифры, указывающей на номер углеродного атома, возле которого стоит радикал. Например: 3- и пишется название самого радикала. Например: 3- метил,7-этил……. Если молекула содержит несколько одинаковых радикалов, то после перечисления всех цифр, указывающих их местоположение, к радикалу добавляют числовую приставку (ди –два, три – три, тетра – четыре). Например: 2,3 – диметил………….., или 3,4,5 – триэтил……. Б) КОРЕНЬ: ставится в соответствии с гомологическим рядом алканов (смотри по количеству атомов углерода в главной цепи) В) СУФФИКС: у алканов суффикс «АН».





5. Угол между атомами углерода в алканах составляет: а) 120 градусов б) 90 градусов в) 109 градусов г) 110 градусов 6. Углеводородный Радикал – это а) группа атомов, соединённая с функциональной группой молекулы. б) группа атомов, отличающаяся от метана на СН2- в) группа атомов, имеющая положительный заряд г) группа атомов, которая называется функциональной

7. Установите порядок для определения названия углеводорода а) Определяют местонахождение радикалов б) Выбирают самую длинную цепь и нумеруют атомы углерода в ней в) Определяют корень названия по числу атомов углерода в длинной цепи г) Составляют приставку в виде цифр и греческих числительных 8. Установите соответствие: 1. Пропан а) СН3-СН2-СН2-СН2-СН2-СН2-СН2- СН3 2. Пентан б) СН3-СН2-СН3 3. Бутан в) СН3-СН2-СН2-СН3 4. Октан г) СН3-СН2-СН2-СН2-СН3

Мело, мело по всей земле
Во все пределы.
Свеча горела на столе,
Свеча горела…
Б.Пастернак
«Зимняя ночь »


РАЗГАДАЙТЕ РЕБУСЫ
НАЗВАНИЯ КАКИХ веществ ЗАШИФРОВАНЫ?

УГЛЕВОДОРОДЫ –
это органические соединения, состоящие из двух химических элементов –
УГЛЕРОДА И ВОДОРОДА.
С – углерод валентность = 4
Н – водород валентность = 1

АЛКАНЫ
(предельные, насыщенные, парафины)
Общая формула
C n H 2 n+ 2
ПАРАФИНЫ
(от лат. parrum affinis – малоактивный).

СТРОЕНИЕ МОЛЕКУЛЫ МЕТАНА
CH 4
Молекулярная формула sp3-гибридизация
Угол между связями HCH 109°28`
строение тетраэдрическое

МЕТАН В ПРИРОДЕ
МЕТАН образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов.
Может быть обнаружен в заболоченных водоемах.

НАХОЖДЕНИЕ АЛКАНОВ В КОСМОСЕ
Метан и этан содержатся в атмосфере планет Солнечной системы: на Юпитере, Сатурне, Уране, Нептуне.
Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах.

ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
алканы
название
агрегатное состояние
температура кипения
Бесцветные газы.
Плохо растворимы в воде.
На воздухе горят.
Ядовиты, вызывают тяжелый наркоз.

ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
алканы
название
агрегатное состояние
Бесцветные жидкости с запахом.
В воде нерастворимы,
легче воды,
на воздухе горят.
температура кипения
Пентадекан

ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Алканы от н-С 17 Н 36 и выше – твердые вещества белого цвета, нерастворимы в воде, легче воды, на воздухе горят. Не ядовиты.

НАХОЖДЕНИЕ АЛКАНОВ В ПРИРОДЕ
ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов .
АЛКАНЫ содержатся в нефти.

ИСПОЛЬЗОВАНИЕ АЛКАНОВ
Алканы являются главным источником органического химического сырья для промышленности.

ИСПОЛЬЗОВАНИЕ АЛКАНОВ
В народном хозяйстве алканы являются основным энергетическим ресурсом.

«ДА-НЕТ» Поставьте знак «+» или «-».
- Молекула метана имеет форму тетраэдра.
- Молекула метана имеет форму треугольника.
- В молекуле метана атом углерода находится в возбужденном состоянии.
- Атом углерода 2-валентен.
- Атом углерода 4-валентен.
- В атоме углерода происходит sp2-гибридизация и образуются 3 гибридных электронных облака.

«ДА-НЕТКА» Поставьте знак «+» или «-».
7. Все связи С ─ Н в молекуле метана одинаковы и расположены под углом 109°28"
8. В природном газе содержится только газ метан.
9. Гомологи ─ это вещества, сходные по строению, но отличающиеся друг от друга на группу атомов ─ СН 2 ─ (гомологическая разность).
10. Группа атомов (СН 3 ─) − это гомологическая разность.

ПРОВЕРКА
1,3,5,7,9 «+». 2,4,6,8,10 «-».

ДАЙТЕ НАЗВАНИЯ УГЛЕВОДОРОДАМ
СН 3 – СН 2 – С – СН 3
СН 3 – СН – СН – СН – СН 3
СН 3 С 2 Н 5 СН 3

НАПИШИТЕ ФОРМУЛЫ АЛКАНОВ ПО НАЗВАНИЮ
Н 3 Н 2 Н 2 Н 3
С – С – С – С – С
а) 3,3 - ди метил пентан
СН 3 – СН – СН – СН – СН 3
СН 3 СН 3 СН 3
б) 2, 3, 4 - три метил пентан
СН 3 – СН – СН – СН 2 – СН 2 – СН 3
СН 3 С 2 Н 5
в) 2 - метил- 3 -этил гексан

УКАЖИТЕ ИЗОМЕРЫ
а) СН 3 – СН 2 – СН – СН 3 б) СН 3 – СН – СН 3 в) СН 3
СН 3 СН 3 СН 3 – С – СН 3
г) СН 3 – СН 2 – СН 2 – СН – СН 3
СН 3 е) СН 3 – СН 2 – СН 2 – СН 3
д) СН 3 – СН 2 – СН 2 – СН 2 – СН 3
ж) СН 3 – СН – СН – СН 3 з) СН 3 – СН 2 – СН 2 – СН 2 – СН 2 – СН 3
Ответ: а) , в), д)

- Учебник п.11
- Р.т.(синяя)-стр20-21№3

все возможные продукты. Реакция бромирования алканов – селективная, т.к. образуются далеко не все возможные продукты.
Бромирование алканов
Вернуться к содержанию
CH4 + Br2===CH3Br + HBr механизм реакции «Sr». Аналогично: CH3-CH3+ Br2=== CH3-CH2Br + HBr. Йод же с алканами реагирует очень медленно или не реагирует вообще. Реакция является обратимой и практического значения не имеет.
Селективность реакций хлорирования и бромирования алканов
Продолжить просмотр химических свойств
В случаях хлорирования и бромирования простых линейных алканов данный вопрос не актуален, т.к. основной продукт реакции только один… Если же мы рассмотрим реакции хлорирования и бромирования н-пропана, то обнаружим существенные различия: в случае хлорирования пропана в качестве продуктов мы получим 1-хлорпропан и 2-хлорпропан, т.е. хлор будет замещать атом водорода у первого и у второго атома углерода; в случае же бромирования пропана Br будет замещать водород только у второго атома С… Такая тенденция будет наблюдаться и при дальнейшем увеличении цепи реагирующего алкана. Cl соединяется со всеми радикалами, а бром только с самым устойчивым радикалом (который существует дольше по времени). Это объясняется их различной химической активностью, бром более «медлительный» и хуже вступает в соединение. В случае с пропаном бром соединился с более устойчивым вторичным радикалом.
Слайд 1
Описание слайда:
Слайд 2

Описание слайда:
Слайд 3

Описание слайда:
Слайд 4

Описание слайда:
Слайд 5

Описание слайда:
Слайд 6

Описание слайда:
Слайд 7

Описание слайда:
Слайд 8

Описание слайда:
Слайд 9

Описание слайда:
Слайд 10

Описание слайда:
Слайд 11

Описание слайда:
Слайд 12

Описание слайда:
Слайд 13

Описание слайда:
Слайд 14

Описание слайда:
Слайд 15

Описание слайда:
Слайд 16

Описание слайда:
Слайд 17

Описание слайда:
Слайд 18

Описание слайда:
Слайд 19

Описание слайда:
Слайд 20

Описание слайда:
Слайд 21

Описание слайда:
Слайд 22

Описание слайда:
Слайд 23

Описание слайда:
Слайд 24

Описание слайда:
Слайд 25

Описание слайда:
Слайд 26

Описание слайда:
Слайд 27

Описание слайда:
Слайд 28

Описание слайда:
Слайд 29

Описание слайда:
Слайд 30

Описание слайда:
Слайд 31

Описание слайда:
Слайд 32

Описание слайда:
Слайд 33

Описание слайда:
КАРБОНОВЫЕ КИСЛОТЫ Карбоновые кислоты - органические соединения, молекулы которых содержат одну или несколько карбоксильных групп -СООН, связанных с углеводородным радикалом. Изучение карбоновых кислот лучше начинать с рассмотрения одноосновных насыщенных кислот, общая формула которых Сп Н2п+1СООН. Карбоновые кислоты бывают одноосновные или монокарбоновые; по характеру углеводородного радикала различают предельные, непредельные и ароматические кмслоты. Названия карбоновых кислот по систематической номенклатуре производчт от названия предельных углеводородов с добавлением окончания –овая и слова кислота.Нумерацич главной цепи начинается с углерода, входящего в состав карбоксильной группы.
Слайд 35

Описание слайда:
Слайд 36

Описание слайда:
Слайд 37

Описание слайда:
Сложные эфиры, R-COOR" - производные карбоновых кислот, в которых гидраксильная группа –ОН карбоксила замещена на группу OR‘. Их получают при взаимодействии карбоновой кислоты со спиртом (катализатор – сильная кислота): Сложные эфиры, R-COOR" - производные карбоновых кислот, в которых гидраксильная группа –ОН карбоксила замещена на группу OR‘. Их получают при взаимодействии карбоновой кислоты со спиртом (катализатор – сильная кислота): Образование сложного эфира из кислоты и спирта называется реакцией этерификации. Это обратимый процесс. Обратная реакция - гидролиз сложного эфира. Установлено, что при этерификации от кислоты отщепляется гидроксил, а от спирта водород (т.е. спирт выступает в качестве нуклеофила, образуя связь с карбонильным атомом углерода за счет своей неподеленной электронной пары). Амиды (R-CONH2) – производные карбоновых кислот, в которых гидроксильная группа –ОН замещена на аминогруппу –NH2. Амиды получают при взаимодействии кислот с аммиаком при нагревании для разложения образующейся аммониевой соли.
Описание слайда:Аминокислоты Аминокислоты - органические соединения, содержащие в молекуле два типа функциональных групп: карбоксильную -СООН, и аминогруппу -NН2, т.е относится к гетерофункциональным соединениям. Аминокислоты можно также рассматривать как производные карбоновых кислот, содержащих в радикале одну или несколько аминогрупп. Аминокислоты играют огромную роль в жизни животных и растительных организмов, так как являются теми структурными элементами, из которых построены молекулы важнейшего природного полимера - белка - основы всего живого. Классифицируются аминокислоты по взаимному расположению функциональных групп, по числу и характеру функциональных групп, по химической природе радикала R -аминокислот. Для аминокислот применима международная номенклатура (ИЮПАК), но чаще используют тривиальные названия. Тривиальные названия -аминокислот обычно связаны с источником выделения.
Слайд 41

Описание слайда:
Слайд 42

Описание слайда:
С катионами тяжелых металлов а -аминокислоты как бифункциональные соединения, образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди (П) в мягких условиях получаются хорошо кристаллизующиеся хелатные С катионами тяжелых металлов а -аминокислоты как бифункциональные соединения, образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди (П) в мягких условиях получаются хорошо кристаллизующиеся хелатные соли меди (П) синего цвета (от греч. "хела" - клешня). Эти комплексы хорошо растворимы в воде, в некоторых органических растворителях и широко используются для обнаружения - аминокислот в аналитической химии. Благодаря своей амфотерности аминокислоты в живом организме играют роль буферных веществ, поддерживающих определенную концентрацию водородных ионов.
Слайд 43

Описание слайда: