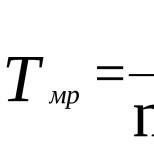Коррозия: виды коррозии, способы защиты. Коррозия: виды, способы защиты. Антикоррозийная защита неметаллическими покрытиями
Основной материал для изучения темы:
§ 13, стр. 81.
Габриелян, О. С.
Химия. 9 класс: Дрофа, 2013.
Дополнительный материал по теме «Коррозия металлов»
Корро́зия , ржавление, ржа - это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево илиполимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример - кислородная коррозия железа в воде:
Гидроксид железа Fe(OH) 3 и является тем, что называют ржавчиной.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозииполимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Классификация видов коррозии
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
газовая коррозия;
атмосферная коррозия;
коррозия в неэлектролитах;
коррозия в электролитах;
подземная коррозия;
биокоррозия;
коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды:
контактная коррозия;
щелевая коррозия;
коррозия при неполном погружении;
коррозия при полном погружении;
коррозия при переменном погружении;
коррозия при трении;
межкристаллитная коррозия;
коррозия под напряжением.
По характеру разрушения:
равномерная;
неравномерная;
избирательная;
язвенная;
точечная;
сквозная;
межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
сплошная коррозия, охватывающая всю поверхность:
локальная (местная) коррозия, охватывающая отдельные участки:
Главная классификация производится по механизму протекания процесса. Различают два вида:
химическую коррозию;
электрохимическую коррозию.
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Коррозия металлов
 Ржавчина,
самый распространённый вид коррозии.
Ржавчина,
самый распространённый вид коррозии.

Коррозия металла.
Коррозия металлов - разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса - «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, - коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Типы коррозии
Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды - либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO 2 , образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки - цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.
Примером крупномасштабной электрохимической коррозии может служить происшествие, случившееся в декабре 1967 года с норвежским рудовозом «Анатина» (англ. Anatina ), следовавшим из Кипра в Осаку. Налетевший в Тихом океане тайфун привёл к попаданию в трюмы солёной воды и образованию большойгальванической пары: медного концентрата со стальным корпусом судна, который вскоре размягчился, и судно подало сигнал бедствия. Экипаж был спасён подоспевшим немецким судном, а сама «Анатина» еле-еле добралась до порта.
Водородная и кислородная коррозия
Если происходит восстановление ионов H 3 O + или молекул воды H 2 O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:
2H 3 O + + 2e − → 2H 2 O + H 2
2H 2 O + 2e − → 2OH − + H 2
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
O 2 + 2H 2 O + 4e − → 4OH −
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.
Химическая коррозия
Электрокоррозия полотенцесушителя
Химическая коррозия - взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисления металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
Виды коррозии
Газовая коррозия
Атмосферная коррозия
Коррозия при неполном погружении
Коррозия по ватерлинии
Коррозия при полном погружении
Коррозия при переменном погружении
Подземная коррозия
Биокоррозия
Коррозия внешним током
Коррозия блуждающим током
Контактная коррозия
Коррозия при трении
Фреттинг-коррозия
Сплошная коррозия
Равномерная коррозия
Неравномерная коррозия
Местная коррозия
Подповерхностная коррозия
Точечная коррозия
Коррозия пятнами
Сквозная коррозия
Послойная коррозия
Нитевидная коррозия
Структурная коррозия
Межкристаллитная коррозия
Избирательная коррозия
Графитизация чугуна
Обесцинкование
Щелевая коррозия
Ножевая коррозия
Коррозионная язва
Коррозионное растрескивание
Коррозия под напряжением
Коррозионная усталость
Предел коррозионной усталости
Коррозионная хрупкость
Борьба с коррозией
Коррозия приводит ежегодно к миллиардным убыткам, и решение этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения . Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата являетсяабразивоструйная очистка.
Обычно выделяют три направления методов защиты от коррозии:
Конструкционный
Активный
Пассивный
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы. При проектировании конструкции стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод - использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.
В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод).
Кислородная коррозия оцинкованного железа
Кислородная коррозия железа, покрытого оловом
Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и корродирует первым. Ионы Zn 2+ токсичны. При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова корродировать, притом усиленно, начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии - применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создаётся коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты. Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб. Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки.
Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее корродируют они медленнее вследствие образования на поверхности защитной оксидной плёнки, которая защищает металл от дальнейшей коррозии. Образование такой плёнки называют пассивацией металла. У алюминия её усиливают анодным окислением (анодирование). При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная плёнка. Содержание хрома в нержавеющей стали - более 12 процентов.
Газотермическое напыление
Для борьбы с коррозией используют также методы газотермического напыления. С помощью газотермического напыления на поверхности металла создается слой из другого металла/сплава, обладающий более высокой стойкостью к коррозии (изолирующий) или наоборот менее стойкий (протекторный). Такой слой позволяет остановить коррозию защищаемого металла. Суть метода такова: газовой струей на поверхность изделия на огромной скорости наносят частицы металлической смеси, например цинк, в результате чего образуется защитный слой толщиной от десятков до сотен микрон. Газотермическое напыление также применяется для продления жизни изношенных узлов оборудования: от восстановления рулевой рейки в автосервисе до нефтедобывающих компаний
Термодиффузионное цинковое покрытие
Для эксплуатации металлоизделий в агрессивных средах, необходима более стойкая антикоррозионная защита поверхности металлоизделий. Термодиффузионное цинковое покрытие является анодным по отношению к чёрным металлам и электрохимически защищает сталь от коррозии. Оно обладает прочным сцеплением (адгезией) с основным металлом за счет взаимной диффузии железа и цинка в поверхностных интерметаллидных фазах, поэтому не происходит отслаивания и скалывания покрытий при ударах, механических нагрузках и деформациях обработанных изделий.
Диффузионное цинкование, осуществляемое из паровой или газовой фазы при высоких температурах (375-850 °C), или с использованием разрежения (вакуума) - при температуре от 250 °C, применяется для покрытия крепёжных изделий, труб, деталей арматуры и др. конструкций. Значительно повышает стойкость стальных, чугунных изделий в средах, содержащих сероводород (в том числе против сероводородного коррозионного растрескивания), промышленной атмосфере, морской воде и др. Толщина диффузионного слоя зависит от температуры, времени, способа цинкования и может составлять 0,01-1,5 мм. Современный процесс диффузионного цинкования позволяет образовывать покрытие на резьбовых поверхностях крепёжных изделий, без затруднения их последующего свинчивания. Микротвёрдость слоя покрытия Hμ = 4000 - 5000 МПа. Диффузионное цинковое покрытие также значительно повышает жаростойкость стальных и чугунных изделий, при температуре до 700 °C. Возможно получение легированных диффузионных цинковых покрытий, применяемое для повышения их служебных характеристик.
Кадмирование
Покрытие стальных деталей кадмием производится методами, аналогичными цинкованию, но даёт более сильную защиту, особенно в морской воде. Применяется значительно реже из-за значительной токсичности кадмия и его дороговизны.
Хромирование

Коррозия ухудшает работутрубопроводов.
Экономические потери от коррозии металлов огромны. В США по последним данным NACE [ ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.

Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Поинт Плезант, штат Западная Виржиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виржинией и Огайо. Причиной обрушения стала коррозия
Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Домашняя работа
Сплавы
Внимание!!!
Для получения оценки «3» достаточно выполнить только первую часть работы, для получения оценки «4», необходимо выполнить без ошибок всю часть работы на «3» и также без ошибок всю часть работы на оценку «4». Для получения оценки «5» необходимо выполнить всю работу без ошибок!!!
Оценка «3»
1. Какой из металлов как простое вещество более подвержен коррозии
1) 1s 2 2s 2 2p 6 3s
2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
4) 1s 2 2s 2 2p 6 3s 2 3p 1
2. Химическую коррозию вызывают
1) вода и кислород
2) оксиды углероды и серы
3) растворы солей
4) все перечисленные факторы.
3. При контакте Ni и Fe в растворе кислоты
1) железо будет растворяться
2) железо будет восстанавливаться
3) никель будет растворяться
4) будет выделяться кислород
Оценка «4»
4. Способы защиты от коррозии, при котором в рабочую среду вводят вещества, уменьшающие агрессивность среды, называют
5. Способ защиты от коррозии, при котором железный лист покрывают слоем олова
6. Наиболее активно корродирует
1) химически чистое железо
2) железо, покрытое слоем олова
3) техническое железо
4) сплав железа с титаном
Оценка «5»
7. Легирующий элемент, сообщающий стали коррозионную стойкость
8. Масса меди, выделившейся на пластинке помещенной в растворе хлорида меди (II) если в реакцию вступил цинк массой 13г
8. Масса меди, выделившейся на железной пластинке помещенной в раствор сульфата меди (II), если в реакцию вступило железо массой 11,2 г.
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией. Коррозия металлов вызывается , в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов :
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют . Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов – может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Сплошность такой пленки оценивают величине фактора Пиллинга-Бэдвордса: (α = V ок /V Ме) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
α = V ок /V Ме = М ок ·ρ Ме /(n·A Me ·ρ ок) ,
где V ок — объем образовавшегося оксида
V Ме — объем металла, израсходованный на образование оксида
М ок – молярная масса образовавшегося оксида
ρ Ме – плотность металла
n – число атомов металла
A Me — атомная масса металла
ρ ок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1 , не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается , вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения α для некоторых оксидов металлов
| металл | оксид | α | металл | оксид | α |
| K | K 2 O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na 2 O | 0,55 | Ag | Ag 2 O | 1,58 |
| Li | Li 2 O | 0,59 | Zr | ZrO 2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu 2 O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti 2 O 3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr 2 O 3 | 2,07 |
| Al | Al 2 O 2 | 1,28 | Fe | Fe 2 O 3 | 2,14 |
| Sn | SnO 2 | 1,33 | W | WO 3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных , который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией .
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде
2H + +2e — = H 2 разряд водородных ионов
2H 3 O + +2e — = H 2 + 2H 2 O
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде
O 2 + 4H + +4e — = H 2 O восстановление растворенного кислорода
O 2 + 2H 2 O + 4e — = 4OH —
Все металлы, по их отношению к электрохимической коррозии , можно разбить на 4 группы, которые определяются величинами их :
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O 2 + 4H + + 4e — = 2H 2 O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO 2 , H 2 S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием . Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием .
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным .
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия.
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al 2 O 3 , ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe 3 (PO 4) 2 , Mn 3 (PO 4) 2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором . Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Категории ,Коррозия - это разрушение металлических, керамических, деревянных и других материалов в результате химического или физико-химического взаимодействия. Что же касается причин возникновения такого нежелательного эффекта, то они разные. В большинстве случаев это конструкционная неустойчивость к термодинамическим воздействиям окружающей среды. Давайте подробно разберемся с тем, что такое коррозия. Виды коррозии тоже обязательно нужно рассмотреть, да и о защите от нее поговорить не будет лишним.
Немного общих сведений
Мы привыкли слышать термин «ржавление», который применяется в случае коррозии металла и сплавов. Есть еще такое понятие, как «старение», - оно свойственно полимерам. По сути, это одно и то же. Яркий пример - старение резиновых изделий из-за активного взаимодействия с кислородом. Помимо этого, некоторые пластиковые элементы разрушаются под воздействием Скорость протекания коррозии напрямую зависит от условий, в которых находится объект. Так, ржавчина на металлическом изделии будет распространяться тем быстрее, чем выше температура. Также влияет и влажность: чем она выше, тем быстрее непригодным для дальнейшей эксплуатации. Опытным путем установлено, что примерно 10 процентов металлических изделий безвозвратно списываются, и виной всему - коррозия. Виды коррозии бывают различными и классифицируются в зависимости от типа сред, характера протекания и тому подобного. Давайте рассмотрим их более подробно.
Классификация
В настоящее время существует более двух десятков вариантов ржавления. Мы приведем только самые основные виды коррозии. Условно их можно поделить на следующие группы:
- Химическая коррозия - процесс взаимодействия с коррозионной средой, при котором и восстановление окислителя проходят в одном акте. Металл и окислитель не разделены пространственно.
- Электрохимическая коррозия - процесс взаимодействия металла с Ионизация атомов и восстановление окислителя проходят в разных актах, однако скорость во многом зависит от электродного потенциала.
- Газовая коррозия - химическое ржавление металла при минимальном содержании влаги (не более 0,1 процента) и/или высоких температурах в газовой среде. Чаще всего данный вид встречается в химической и нефтеперерабатывающей промышленности.

Помимо этого, существует еще огромное количество процессов ржавления. Все они и есть коррозия. Виды коррозии, кроме вышеописанных, включают биологическое, радиоактивное, атмосферное, контактное, местное, целевое ржавление и др.
Электрохимическая коррозия и ее особенности
При таком виде разрушения процесс протекает при соприкосновении металла с электролитом. В качестве последнего может выступать конденсат или дождевая вода. Чем больше в жидкости содержится солей и кислот, тем выше электропроводность, а следовательно, и скорость протекания процесса. Что же касается наиболее подверженных коррозии мест металлической конструкции, то это заклепки, сварные соединения, места механических повреждений. В случае если конструкционные свойства сплава железа делают его устойчивым к ржавлению, процесс несколько замедляется, однако все равно продолжается. Ярким примером является оцинковка. Дело в том, что цинк имеет более отрицательный потенциал, нежели железо. По этой простой причине сплав железа восстанавливается, а цинк коррозирует. Однако наличие на поверхности оксидной пленки сильно замедляет процесс разрушения. Безусловно, все виды электрохимической коррозии являются крайне опасными и иногда с ними даже невозможно бороться.

Химическая коррозия
Такое изменение металла встречается довольно часто. Ярким примером является появление окалины в результате взаимодействия металлических изделий с кислородом. Высокая температура в этом случае выступает ускорителем процесса, а участвовать в нем могут такие жидкости, как вода, соли, кислоты, щелочи и растворы солей. Если говорить о таких материалах, как медь или цинк, то их окисление приводит к возникновению устойчивой к дальнейшей коррозии пленки. Стальные же изделия образуют окиси железа. Дальнейшие приводят к возникновению ржавчины, которая не обеспечивает никакой защиты от дальнейшего разрушения, а наоборот, способствует этому. В настоящее время все виды химической коррозии устраняются при помощи оцинковки. Могут применяться и другие средства защиты.

Виды коррозии бетона
Изменение структуры и увеличение хрупкости бетона под воздействием окружающей среды может быть трех видов:
- Разрушение частей цементного камня - один из самых распространенных видов коррозии. Он имеет место в том случае, если изделие из бетона подвергается систематическому воздействию атмосферных осадков и других жидкостей. В результате вымывается гидрат окиси кальция и нарушается структура.
- Взаимодействие с кислотами. Если цементный камень будет контактировать с кислотами, то образуется бикарбонат кальция - агрессивный химический элемент для бетонного изделия.
- Кристаллизация труднорастворимых веществ. По сути, имеется в виду биокоррозия. Суть заключается в том, что микроорганизмы (споры, грибки) попадают в поры и там развиваются, вследствие чего происходит разрушение.

Коррозия: виды, способы защиты
Миллиардные ежегодные убытки привели к тому, что люди стали бороться с этим вредным воздействием. Можно с уверенностью говорить о том, что все виды коррозии приводят к потере не самого металла, а ценных металлоконструкций, на строительство которых тратятся огромные деньги. Сложно сказать, возможно ли обеспечить 100-процентную защиту. Тем не менее, при правильной подготовке поверхности, которая заключается в абразивоструйной очистке, можно добиться хороших результатов. От электрохимической коррозии надежно защищает лакокрасочное покрытие при правильном его нанесении. А от разрушения металла под землей надежно защитит специальная обработка поверхности.
Активные и пассивные методы борьбы
Суть активных методов заключается в том, чтобы изменить структуру двойного электрического поля. Для этого используют источник постоянного тока. Напряжение нужно выбирать таким образом, чтобы повышался изделия, которое нужно защитить. Еще один крайне популярный метод - «жертвенный» анод. Он разрушается, защищая основной материал.

Пассивная защита подразумевает использование лакокрасочного покрытия. Основная задача заключается в том, чтобы полностью предотвратить попадание влаги, а также кислорода на защищаемую поверхность. Как уже было отмечено несколько выше, имеет смысл использовать цинковое, медное или никелевое напыление. Даже частично разрушенный слой будет защищать металл от ржавления. Конечно, данные виды защиты от коррозии металлов действенны только тогда, когда поверхность не будет иметь видимых дефектов в виде трещин, сколов и тому подобного.
Оцинкование в подробностях
Мы уже с вами рассмотрели основные виды коррозии, а сейчас хотелось бы поговорить о лучших методах защиты. Одним из таких является оцинкование. Суть его заключается в том, что на обрабатываемую поверхность наносится цинк или его сплав, что придает поверхности некоторые физико-химические свойства. Стоит отметить, что данный метод считается одним из самых экономичных и эффективных, и это при том, что на металлизацию цинком расходуется примерно 40 процентов от мировой добычи этого элемента. Оцинкованию могут подвергаться стальные листы, крепежные детали, а также приборы и другие металлоконструкции. Интересно то, что с помощью металлизации или распыления можно защитить изделие любого размера и формы. Декоративного назначения цинк не имеет, хотя с помощью некоторых специальных добавок появляется возможность получения блестящих поверхностей. В принципе, этот металл способен обеспечить максимальную защиту в агрессивных средах.
Заключение

Вот мы и рассказали вам о том, что такое коррозия. Виды коррозии тоже были рассмотрены. Теперь вы знаете, как защитить поверхность от преждевременного ржавления. По большому счету, сделать это предельно просто, но немалое значение имеет то, где и как эксплуатируется изделие. Если оно постоянно подвергается динамическим и вибрационным нагрузкам, то велика вероятность возникновения трещин в лакокрасочных покрытиях, через которые влага будет попадать на металл, в результате чего он будет постепенно разрушаться. Тем не менее, использование различных резиновых прокладок и герметиков в местах взаимодействия металлических изделий может несколько продлить срок службы покрытия.
Ну, вот и все по данной теме. Помните о том, что преждевременное разрушение конструкции из-за воздействия коррозии может привести к непредвиденным последствиям. На предприятии большой материальный ущерб и человеческие жертвы возможны в результате ржавления несущей металлоконструкции.
физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы.Слово коррозия происходит от латинского «corrodo» «грызу» (позднелатинское «corrosio» означает «разъедание»).
Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением:
Fe + 6 H 2 O (влага) + 3 O 2 (воздух) = 4 Fe (OH ) 3Гидроксид железа(
III ) очень неустойчив, быстро теряет воду и превращается в оксид железа(III ). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.Многие металлы, в том числе и довольно активные (например, алюминий) при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.
Алюминий в обычных условиях устойчив к воздействию воздуха и воды, даже кипящей, однако если на поверхность алюминия нанести ртуть, то образующаяся амальгама разрушает оксидную пленку выталкивает ее с поверхности, и металл быстро превращается в белые хлопья метагидроксида алюминия:
4Al + 2H 2 O + 3O 2 = 4AlO(OH) Амальгамированный алюминий взаимодействует с водой с выделением водорода: Al + 4 H 2 O = 2 AlO (OH ) + 3 H 2Коррозии подвергаются и некоторые довольно мало активные металлы. Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования смеси основных солей.
Иногда при коррозии металлов происходит не окисление, а восстановление некоторых элементов, содержащихся в сплавах. Например, при высоких давлениях и температурах карбиды, содержащиеся в сталях, восстанавливаются водородом.
Разрушение металлов в присутствии водорода обнаружили в середине девятнадцатого века. Французский инженер Сент Клэр Девиль изучал причины неожиданных разрывов орудийных стволов. При их химическом анализе он нашел в металле водород. Девиль решил, что именно водородное насыщение явилось причиной внезапного падения прочности стали.
Много хлопот доставил водород конструкторам оборудования для одного из важнейших промышленных химических процессов синтеза аммиака. Первые аппараты для этого синтеза служили лишь десятки часов, а затем разлетались на мелкие части. Только добавление в сталь титана, ванадия или молибдена помогло решить эту проблему.
К коррозии металлов можно отнести также их растворение в жидких расплавленных металлах (натрий, свинец, висмут), которые используются, в частности, в качестве теплоносителей в ядерных реакторах.
По стехиометрии реакции, описывающие коррозию металлов, довольно просты, однако по механизму они относятся к сложным гетерогенным процессам. Механизм коррозии определяется, прежде всего, типом агрессивной среды.
При контакте металлического материала с химически активным газом на его поверхности появляется пленка продуктов реакции. Она препятствует дальнейшему контакту металла и газа. Если сквозь эту пленку происходит встречная диффузия реагирующих веществ, то реакция продолжается. Процесс облегчается при высоких температурах. В ходе коррозии пленка продукта непрерывно утолщается, а металл разрушается. Большие убытки от газовой коррозии терпит металлургия и другие отрасли промышленности, где используются высокие температуры.
Наиболее распространена коррозия в средах электролитов. В некоторых технологических процессах металлы контактируют с расплавами электролитов. Однако чаще всего коррозия протекает в растворах электролитов. Металл не обязательно должен быть полностью погружен в жидкость. Растворы электролитов могут находиться в виде тонкой пленки на поверхности металла. Они нередко пропитывают окружающую металл среду (почву, бетон и др.).
Во время строительства метромоста и станции «Ленинские горы» в Москве в бетон добавляли большое количество хлорида натрия, чтобы не допустить замерзания еще не схватившегося бетона. Станция была сооружена в кратчайшие сроки (всего за 15 месяцев) и открыта 12 января 1959. Однако присутствие хлорида натрия в бетоне вызвало разрушение стальной арматуры. Коррозии оказались подвергнуты 60% железобетонных конструкций, поэтому станция была закрыта на реконструкцию, продолжавшуюся почти 10 лет. Лишь 14 января 2002 состоялось повторное открытие метромоста и станции, получившей название «Воробьевы горы».
Использование солей (обычно хлорида натрия или кальция) для удаления снега и льда с дорог и тротуаров также приводит к ускоренному разрушению металлов. Сильно страдают транспортные средства и подземные коммуникации. Подсчитано, что только в США применение солей для борьбы со снегопадами и гололедом приводит к потерям на сумму около 2 млрд. долл. в год в связи с коррозией двигателей и 0,5 млрд. долл. на дополнительный ремонт дорог, подземных магистралей и мостов.
В средах электролитов коррозия обусловлена не только действием кислорода, воды или кислот на металлы, но и электрохимическими процессами. Уже в начале 19 в. электрохимическую коррозию изучали английские ученые Гемфри Дэви и Майкл Фарадей. Первая теория электрохимической коррозии была выдвинута в 1830 швейцарским ученым Де ла Ривом. Она объясняла возникновение коррозии в месте контакта двух разных металлов.
Электрохимическая коррозия приводит к быстрому разрушению более активных металлов, которые в различных механизмах и устройствах контактируют с менее активными металлами, расположенными в электрохимическом ряду напряжений правее. Использование медных или латунных деталей в железных или алюминиевых конструкциях, которые работают в морской воде, существенно усиливает коррозию. Известны случаи разрушения и затопления кораблей, железная обшивка которых была скреплена медными заклепками.
По отдельности алюминий и титан устойчивы к действию морской воды, но если они контактируют в одном изделии, например в боксе для подводной фототехники, алюминий очень быстро разрушается, и бокс протекает.
Электрохимические процессы могут протекать и в однородном металле. Они активизируются, если есть различия в составе зерна металла в объеме и на границе, неоднородное механическое напряжение, микропримеси и т.д. В разработке общей теории электрохимической коррозии металлических материалов участвовали многие наши соотечественники, в том числе Владимир Александрович Кистяковский (18651952) и Александр Наумович Фрумкин (18951976).
Одной из причин возникновения электрохимической коррозии являются блуждающие токи, которые появляются вследствие утечки части тока из электрических цепей в почву или водные растворы, где они попадают на металлические конструкции. В местах выхода тока из этих конструкций вновь в почву или воду начинается растворение металла. Такие зоны разрушения металлов под действием блуждающих токов особенно часто наблюдаются в районах наземного электрического транспорта (трамвайные линии, железнодорожный транспорт на электрической тяге). Эти токи могут достигать несколько ампер, что приводит к большим коррозионным разрушениям. Например, прохождение тока силой в 1 А в течение одного года вызовет растворение 9,1 кг железа, 10,7 кг цинка, 33,4 кг свинца.
Коррозия может возникать и под влиянием радиационного излучения, а также продуктов жизнедеятельности бактерий и других организмов. С развитием бактерий на поверхности металлических конструкций связано явление биокоррозии. Обрастание подводной части судов мелкими морскими организмами также оказывает влияние на коррозионные процессы.
При одновременном воздействии на металл внешней среды и механических напряжений все коррозионные процессы активизируются, поскольку при этом понижается термическая устойчивость металла, нарушаются оксидные пленки на поверхности металла, усиливаются электрохимические процессы в местах появления трещин и неоднородностей.
Коррозия приводит к огромным безвозвратным потерям металлов, ежегодно полностью разрушается около 10% производимого железа. По данным Института физической химии РАН, каждая шестая домна в России работает впустую весь выплавляемый металл превращается в ржавчину. Разрушение металлических конструкций, сельскохозяйственных и транспортных машин, промышленной аппаратуры становится причиной простоев, аварий, ухудшения качества продукции. Учет возможной коррозии приводит к повышенным затратам металла при изготовлении аппаратов высокого давления, паровых котлов, металлических контейнеров для токсичных и радиоактивных веществ и т.д. Это увеличивает общие убытки от коррозии. Немалые средства приходится тратить на противокоррозионную защиту. Соотношение прямых убытков, косвенных убытков и расходов на защиту от коррозии оценивают как (34):1:1. В промышленно развитых странах ущерб от коррозии достигает 4% национального дохода. В нашей стране он исчисляется миллиардами рублей в год.
Проблемы коррозии постоянно обостряются из-за непрерывного роста производства металлов и ужесточения условий их эксплуатации. Среда, в которой используются металлические конструкции, становится все более агрессивной, в том числе и за счет ее загрязнения. Металлические изделия, используемые в технике, работают в условиях все более высоких температур и давлений, мощных потоков газов и жидкостей. Поэтому вопросы защиты металлических материалов от коррозии становятся все более актуальными. Полностью предотвратить коррозию металлов невозможно, поэтому единственным путем борьбы с ней является поиск способов ее замедления.
Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (5 в. до н. э.) и древнеримского ученого Плиния Старшего (1 в. до н. э.) уже есть упоминания о применении олова для предохранения железа от ржавления. В настоящее время борьбу с коррозией ведут сразу в нескольких направлениях пытаются изменить среду, в которой работает металлическое изделие, повлиять на коррозионную устойчивость самого материала, предотвратить контакт между металлом и агрессивными веществами внешней среды.
Полностью предотвратить коррозию можно только в инертной среде, например в атмосфере аргона, однако реально создать такую среду при эксплуатации конструкций и механизмов в подавляющем большинстве случаев невозможно. На практике для снижения коррозионной активности среды из нее стараются удалить наиболее реакционноспособные компоненты, например, снижают кислотность водных растворов и почв, с которыми могут контактировать металлы. Одним из методов борьбы с коррозией железа и его сплавов, меди, латуни, цинка, свинца является удаление из водных растворов кислорода и диоксида углерода. В энергетике и некоторых отраслях техники воду освобождают также от хлоридов, которые стимулируют локальную коррозию. Для снижения кислотности почвы проводят известкование.
Агрессивность атмосферы сильно зависит от влажности. Для любого металла есть некоторая критическая относительная влажность, ниже которой он не подвергается атмосферной коррозии. Для железа, меди, никеля, цинка она составляет 5070%. Иногда для сохранности изделий, имеющих историческую ценность, их температуру искусственно поддерживают выше точки росы. В закрытых пространствах (например, в упаковочных коробках) влажность понижают с помощью силикагеля или других адсорбентов. Агрессивность промышленной атмосферы определяется, в основном продуктами сгорания топлива (см . ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ ). Уменьшению потерь от коррозии способствует предотвращение кислотных дождей и устранение вредных газовых выбросов.
Разрушение металлов в водных средах можно замедлить при помощи ингибиторов коррозии, которые в небольших количествах (обычно менее 1%) вводят в водные растворы. Они способствуют пассивированию поверхности металла, то есть образованию тонкой и плотной пленки оксидов или других малорастворимых соединений, которая препятствует разрушению основного вещества. Для этой цели применяют некоторые соли натрия (карбонат, силикат, борат) и другие соединения. Если бритвенные лезвия погрузить в раствор хромата калия, они хранятся намного дольше. Часто используют органические ингибиторы, которые более эффективны, чем неорганические.
Один из способов защиты от коррозии основывается на разработке новых материалов, обладающих более высокой коррозионной стойкостью. Постоянно ведутся поиски заменителей коррозирующих металлов. Пластмассы, керамика, стекло, резина, асбест и бетон более устойчивы к воздействию окружающей среды, однако по многим другим свойствам они уступают металлам, которые по-прежнему служат основными конструкционными материалами.
Благородные металлы практически не поддаются коррозии, но для широкого применения они слишком дороги, поэтому их используют лишь в наиболее ответственных деталях, например для изготовления некорродирующих электрических контактов. Высокой коррозионной стойкостью обладают никель, алюминий, медь, титан и сплавы на их основе. Их производство растет довольно быстро, однако и сейчас наиболее доступным и широко используемым металлом остается быстро ржавеющее железо. Для придания коррозионной стойкости сплавам на основе железа часто используют легирование. Так получают нержавеющую сталь, которая, помимо железа, содержит хром и никель. Самая распространенная в наше время нержавеющая сталь марки 188 (18% хрома и 8% никеля) появилась в 1923. Она вполне устойчива к воздействию влаги и кислорода. Первые тонны нержавеющей стали в нашей стране были выплавлены в 1924 в Златоусте. Сейчас разработано много марок таких сталей, которые, помимо хрома и никеля, содержат марганец, молибден, вольфрам и другие химические элементы. Часто применяют поверхностное легирование недорогих железных сплавов цинком, алюминием, хромом.
Для противостояния атмосферной коррозии на стальные изделия наносятся тонкие покрытия из других металлов, более устойчивых к воздействию влаги и кислорода воздуха. Часто используются покрытия из хрома и никеля. Поскольку хромовые покрытия нередко содержат трещины, их обычно наносят поверх менее декоративных никелевых покрытий. На защиту жестяных консервных банок от коррозии в органических кислотах, содержащихся в пищевых продуктах, расходуется значительное количество олова. Долгое время для покрытия кухонной утвари использовали кадмий, однако теперь известно, что этот металл опасен для здоровья и кадмиевые покрытия используются только в технике.
Для замедления коррозии на поверхность металла наносят лаки и краски, минеральные масла и смазку. Подземные конструкции покрывают толстым слоем битума или полиэтилена. Внутренние поверхности стальных труб и резервуаров защищают дешевыми покрытиями из цемента.
Чтобы лакокрасочное покрытие было более надежным, поверхность металла тщательно очищают от грязи и продуктов коррозии и подвергают специальной обработке. Для стальных изделий используют так называемые преобразователи ржавчины, содержащие ортофосфорную кислоту (Н 3 РО 4) и ее соли. Они растворяют остатки оксидов и формируют плотную и прочную пленку фосфатов, которая способна на некоторое время защитить поверхность изделия. Затем металл покрывают грунтовочным слоем, который должен хорошо ложиться на поверхность и обладать защитными свойствами (обычно используют свинцовый сурик или хромат цинка). Только после этого можно наносить лак или краску.
Одним из наиболее эффективных методов борьбы с коррозией является электрохимическая защита. Для защиты буровых платформ, сварных металлических оснований, подземных трубопроводов их подключают в качестве катода к внешнему источнику тока. В качестве анода используются вспомогательные инертные электроды.
Другой вариант такой защиты применяют для сравнительно небольших стальных конструкций или дополнительно покрытых изоляцией металлических объектов (например, трубопроводов). В этом случае используют протектор анод из сравнительно активного металла (обычно это магний, цинк, алюминий и их сплавы), который постепенно разрушается, оберегая основной объект. С помощью одного магниевого анода защищают до 8 км трубопровода. Протекторная защита широко распространена; например, в США на производство протекторов ежегодно расходуется около 11,5 тыс. т алюминия.
Защита одного металла другим, более активным металлом, расположенным в ряду напряжений левее, эффективна и без наложения разности потенциалов. Более активный металл (например, цинк на поверхности железа) защищает от разрушения менее активный металл.
К электрохимическим методам борьбы с коррозией можно отнести и защиту от разрушения конструкций блуждающими токами. Одним из способов устранения такой коррозии является соединение металлическим проводником участка конструкции, с которого стекает блуждающий ток, с рельсом, по которому движется трамвай или электропоезд.
Елена Савинкина
ЛИТЕРАТУРА Фримантл М. Химия в действии . В 2-х ч. М., Мир, 1991Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения . М., Химия, 1994
Химическая коррозия - это процесс, состоящий в разрушении металла при взаимодействии с агрессивной внешней средой. Химическая разновидность коррозийных процессов не имеет связи с воздействием электрического тока. При этом виде коррозии происходит окислительная реакция, где разрушаемый материал - одновременно восстановитель элементов среды.

Классификация разновидности агрессивной среды включает два вида разрушения металла:
- химическая коррозия в жидкостях-неэлектролитах;
- химическая газовая коррозия.
Газовая коррозия
Самая частая разновидность химической коррозии - газовая - представляет собой коррозийный процесс, происходящий в газах при повышенных температурах. Указанная проблема характерна для работы многих типов технологического оборудования и деталей (арматуры печей, двигателей, турбин и т.д.). Кроме того, сверхвысокие температуры используются при обработке металлов под высоким давлением (нагревание перед прокаткой, штамповкой, ковкой, термическими процессами и т.д.).
Особенности состояния металлов при повышенных температурах обуславливаются двумя их свойствами - жаропрочностью и жаростойкостью. Жаропрочность - это степень устойчивости механических свойств металла при сверхвысоких температурах. Под устойчивостью механических свойств понимается сохранение прочности в течение продолжительного времени и сопротивляемость ползучести. Жаростойкость - это устойчивость металла к коррозионной активности газов в условиях повышенных температур.

Скорость развития газовой коррозии обуславливается рядом показателей, в числе которых:
- температура атмосферы;
- компоненты, входящие в металл или сплав;
- параметры среды, где находятся газы;
- продолжительность контактирования с газовой средой;
- свойства коррозийных продуктов.
На коррозийный процесс больше влияние оказывают свойства и параметры оксидной пленки, появившейся на металлической поверхности. Образование окисла можно хронологически разделить на два этапа:
- адсорбция кислородных молекул на металлической поверхности, взаимодействующей с атмосферой;
- контактирование металлической поверхности с газом, в результате чего возникает химическое соединение.

Первый этап характеризуется появлением ионной связи, как следствие взаимодействия кислорода и поверхностных атомов, когда кислородный атом отбирает пару электроном у металла. Возникшая связь отличается исключительной силой - она больше, нежели связь кислорода с металлом в окисле.
Объяснение такой связи кроется в действии атомного поля на кислород. Как только поверхность металла наполняется окислителем (а это происходит очень быстро), в условиях низких температур, благодаря силе Ван-дер-Ваальса, начинается адсорбция окислительных молекул. Результат реакции - возникновение тончайшей мономолекулярной пленки, которая с течением времени становится толще, что усложняет доступ кислорода.
На втором этапе происходит химическая реакция, в ходе которой окислительный элемент среды отбирает у металла валентные электроны. Химическая коррозия - конечный результат реакции.
Характеристики оксидной пленки
Классификация оксидных пленок включает их три разновидности:
- тонкие (незаметны без специальных приборов);
- средние (цвета побежалости);
- толстые (видны невооруженным взглядом).
Появившаяся оксидная пленка имеет защитные возможности - она замедляет или даже полностью угнетает развитие химической коррозии. Также наличие оксидной пленки повышает жаростойкость металла.
Однако, действительно эффективная пленка должна отвечать ряду характеристик:
- быть не пористой;
- иметь сплошную структуру;
- обладать хорошими адгезивными свойствами;
- отличаться химической инертностью в отношении с атмосферой;
- быть твердой и устойчивой к износу.
Одно из указанных выше условий - сплошная структура имеет особенно важное значение. Условие сплошности - превышение объема молекул оксидной пленки над объемом атомов металла. Сплошность - это возможность окисла накрыть сплошным слоем всю металлическую поверхность. При несоблюдении этого условия, пленка не может считаться защитной. Однако, из этого правила имеются исключения: для некоторых металлов, например, для магния и элементов щелочно-земельной групп (исключая бериллий), сплошность не относится к критически важным показателям.

Чтобы установить толщину оксидной пленки, используются несколько методик. Защитные качества пленки можно выяснить в момент ее образования. Для этого изучаются скорость окисления металла, и параметры изменения скорости во времени.
Для уже сформированного окисла применяется другой метод, состоящий в исследовании толщины и защитных характеристик пленки. Для этого на поверхность накладывается реагент. Далее специалисты фиксируют время, которое понадобится на проникновение реагента, и на основании полученных данных делают вывод о толщине пленки.
Обратите внимание! Даже окончательно сформировавшаяся оксидная пленка продолжает взаимодействовать с окислительной средой и металлом.
Скорость развития коррозии
Интенсивность, с какой развивается химическая коррозия, зависит от температурного режима. При высокой температуре окислительные процессы развиваются стремительнее. Причем снижение роли термодинамического фактора протекания реакции не влияет на процесс.
Немалое значение имеет охлаждение и переменный нагрев. Из-за термических напряжений в оксидной пленке появляются трещины. Через прорехи окислительный элемент попадает на поверхность. В результате образуется новый слой оксидной пленки, а прежний - отслаивается.

Не последнюю роль играют и компоненты газовой среды. Этот фактор индивидуален для разных видов металлов и согласуется с температурными колебаниями. К примеру, медь быстро поддается коррозии, если она контактирует с кислородом, но отличается устойчивостью к этому процессу в среде оксида серы. Для никеля же напротив, серный оксид губителен, а устойчивость наблюдается в кислороде, диоксиде углерода и водной среде. А вот хром проявляет стойкость ко всем перечисленным средам.
Обратите внимание! Если уровень давления диссоциации окисла превышает давление окисляющего элемента, окислительный процесс останавливается и металл обретает термодинамическую устойчивость.
На скорость окислительной реакции влияют и компоненты сплава. Например, марганец, сера, никель и фосфор никак не способствуют окислению железа. А вот алюминий, кремний и хром делают процесс более медленным. Еще сильнее замедляют окисление железа кобальт, медь, бериллий и титан. Сделать процесс более интенсивным помогут добавки ванадия, вольфрама и молибдена, что объясняется легкоплавкостью и летучестью данных металлов. Наиболее медленно окислительные реакции протекают при аустенитной структуре, поскольку она наиболее приспособлена к высоким температурам.

Еще один фактор, от которого зависит скорость коррозии, - характеристика обработанной поверхности. Гладкая поверхность окисляется медленнее, а неровная - быстрее.
Коррозия в жидкостях-неэлектролитах
К неэлектропроводным жидким средам (т.е. жидкостям-неэлектролитам) относят такие органические вещества, как:
- бензол;
- хлороформ;
- спирты;
- тетрахлорид углерода;
- фенол;
- нефть;
- бензин;
- керосин и т.д.

Кроме того, к жидкостям-неэлектролитам причисляют небольшое количество неорганических жидкостей, таких как жидкий бром и расплавленная сера.
При этом нужно заметить, что органические растворители сами по себе не вступают в реакцию с металлами, однако, при наличии небольшого объема примесей возникает интенсивный процесс взаимодействия.
Увеличивают скорость коррозии находящиеся в нефти серосодержащие элементы. Также, усиливают коррозийные процессы высокие температуры и присутствие в жидкости кислорода. Влага интенсифицирует развитие коррозии в соответствии с электромеханическим принципом.
Еще один фактор быстрого развития коррозии - жидкий бром. При нормальных температурах он особенно разрушительно воздействует на высокоуглеродистые стали, алюминий и титан. Менее существенно влияние брома на железо и никель. Самую большую устойчивость к жидкому брому показывают свинец, серебро, тантал и платина.

Расплавленная сера вступает в агрессивную реакцию почти со всеми металлами, в первую очередь со свинцом, оловом и медью. На углеродистые марки стали и титан сера влияет меньше и почти совсем разрушает алюминий.
Защитные мероприятия для металлоконструкций, находящихся в неэлектропроводных жидких средах, проводят добавлением устойчивым к конкретной среде металлов (например, сталей с высоким содержанием хрома). Также, применяются особые защитные покрытия (например, в среде, где содержится много серы, используют алюминиевые покрытия).
Способы защиты от коррозии
Методы борьбы с коррозией включают:

Выбор конкретного материала зависит от потенциальной эффективности (в том числе технологической и финансовой) его использования.
Современные принципы защиты металла основываются на таких методиках:
- Улучшение химической сопротивляемости материалов. Успешно зарекомендовали себя химически стойкие материалы (высокополимерные пластики, стекло, керамика).
- Изолирование материала от агрессивной среды.
- Уменьшение агрессивности технологической среды. В качестве примеров таких действий можно привести нейтрализацию и удаление кислотности в коррозийных средах, а также использование всевозможных ингибиторов.
- Электрохимическая защита (наложение внешнего тока).
Указанные выше методики подразделяются на две группы:
- Повышение химической сопротивляемости и изолирование применяются до того, как металлоконструкция запускается в эксплуатацию.
- Уменьшение агрессивности среды и электрохимическая защита используются уже в процессе применения изделия из металла. Применение этих двух методик дает возможность внедрять новые способы защиты, в результате которых защита обеспечивается изменением эксплуатационных условий.
Один из самых часто применяемых способов защиты металла - гальваническое антикоррозийное покрытие - экономически нерентабелен при значительных площадях поверхностей. Причина в высоких затратах на подготовительный процесс.

Ведущее место среди способов защиты занимает покрытие металлов лакокрасочными материалами. Популярность такого метода борьбы с коррозией обусловлена совокупностью нескольких факторов:
- высокие защитные свойства (гидрофобность, отталкивание жидкостей, невысокие газопроницаемость и паропроницаемость);
- технологичность;
- широкие возможности для декоративных решений;
- ремонтопригодность;
- экономическая оправданность.
В то же время, использование широкодоступных материалов не лишено недостатков:
- неполное увлажнение металлической поверхности;
- нарушенное сцепление покрытия с основным металлом, что ведет к скапливанию электролита под антикоррозийным покрытием и, таким образом, способствует коррозии;
- пористость, приводящая к повышенной влагопроницаемости.
И все же, окрашенная поверхность защищает металл от коррозийных процессов даже при фрагментарном повреждении пленки, тогда как несовершенные гальванические покрытия способны даже ускорять коррозию.
Органосиликатные покрытия

Химическая коррозия практически не распространяется на органосиликатные материалы. Причины этого кроются в повышенной химической устойчивости таких композиций, их стойкости к свету, гидрофобных качествах и невысоком водопоглощении. Также органосиликаты устойчивы к низким температурам, обладают хорошими адгезивными свойствами и износостойкостью.
Проблемы разрушения металлов из-за воздействия коррозии не исчезают, несмотря на развитие технологий борьбы с ними. Причина в постоянном возрастании объемов производства металлов и все более сложных условий эксплуатации изделий из них. Окончательно решить проблему на данном этапе нельзя, поэтому усилия ученых сосредоточены на поисках возможностей по замедлению коррозионных процессов.