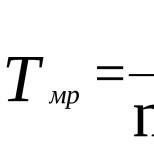7 каково применение электролиза в технике. Самое широкое применение электролиза. Практическое применение электролиза
Получение целевых продуктов путем электролиза позволяет сравнительно просто (регулируя силу тока) управлять скоростью и направленностью процесса, благодаря чему можно осуществлять процессы как в самых "мягких", так и в предельно "жестких" условиях окисления или восстановления, получая сильнейшие окислители и восстановители. Путем электролиза производят Н2 и О2 из воды, Сl2 из водных растворов NaCl, F2 из расплава KF в KH2F3.
Гидроэлектрометаллургия - важная отрасль металлургии цветных металлов (Сu, Bi, Sb, Sn, Pb, Ni, Co, Cd, Zn); она применяется также для получения благородных и рассеянных металлов, Мn, Сr. Электролиз используют непосредственно для катодного выделения металла после того, как он переведен из руды в раствор, а раствор подвергнут очистке. Такой процесс называется электроэкстракцией. Электролиз применяют также для очистки металла - электролитического рафинирования (электрорафинирование). Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов.
Электролиз расплавов электролитов - важный способ производства многих металлов. Так, например, алюминий-сырец получают электролизом криолит-глиноземного расплава (Na3AlF6 + Al2O3), очистку сырца осуществляют электролитическим рафинированием. При этом анодом служит расплав Аl, содержащий до 35% Сu (для утяжеления) и потому находящийся на дне ванны электролизера. Средний жидкий слой ванны содержит ВаСl2, AlF3 и NaF, a верхний - расплавленный рафинированный Аl и служит катодом.
Электролиз расплава хлорида магния или обезвоженного карналлита - наиболее распространенный способ получения Mg. В промышленном масштабе электролиз расплавов используют для получения щелочных и щелочно-земельных металлов, Be, Ti, W, Mo, Zr, U и др.
К электролитическим способам получения металлов относят также восстановление ионов металла другим, более электроотрицательным металлом. Выделение металлов восстановлением их водородом также часто включает стадии электролиза- электрохимическую ионизацию водорода и осаждение ионов металла за счет освобождающихся при этом электронов. Важную роль играют процессы совместного выделения или растворения нескольких металлов, совместного выделения металлов и молекулярного водорода на катоде и адсорбции компонентов раствора на электродах. Электролиз используют для приготовления металлических порошков с заданными свойствами.
Другие важнейшие применения электролиза - гальванотехника, электросинтез, электрохимическая обработка металлов, защита от коррозии.
Электролизеры. Конструкция промышленных аппаратов для проведения электролитических процессов определяется характером процесса. В гидрометаллургии и гальванотехнике используют преимущественно так называемые ящичные электролизеры, представляющие собой открытую емкость с электролитом, в которой размещают чередующиеся катоды и аноды, соединенные соотвктственно с отрицательными и положительными полюсами источника постоянного тока. Для изготовления анодов применяют графит, углеграфитовые материалы, платину, оксиды железа, свинца, никеля, свинец и его сплавы; используют малоизнашивающиеся титановые аноды с активным покрытием из смеси оксидов рутения и титана (оксидные рутениево-титановые аноды, или ОРТА), а также из платины и ее сплавов. Для катодов в большинстве электролизеров применяют сталь, в т.ч. с различными защитными покрытиями с учетом агрессивности электролита и продуктов электролиза, температуры и др. условий процесса. Некоторые электролизеры работают в условиях высоких давлений, например, разложение воды ведется под давлением до 4 МПа; разрабатываются электролизеры и для более высоких давлений. В современных электролизерах широко применяют пластические массы, стекло и стеклопластики, керамику.
Во многих электрохимических производствах требуется разделение катодного и анодного пространств, которое осуществляют с помощью диафрагм, проницаемых для ионов, но затрудняющих механическое смешение и диффузию. При этом достигается разделение жидких и газообразных продуктов, образующихся на электродах или в объеме раствора, предотвращается участие исходных, промежуточных и конечных продуктов электролиза в реакциях на электроде противоположного знака и в приэлектродном пространстве. В пористых диафрагмах через микропоры переносятся как катионы, так и анионы в количествах, соответствующих числам переноса. В ионообменных диафрагмах (мембранах) происходит перенос либо только катионов, либо анионов, в зависимости от природы входящих в их состав ионогенных групп. При синтезе сильных окислителей используют обычно без-диафрагменные электролизеры, но в раствор электролита добавляют K2Сr2О7. В процессе электролиза на катоде образуется пористая хромит-хроматная пленка, выполняющая функции диафрагмы. При получении хлора используют катод в виде стальной сетки, на которую наносят слой асбеста, играющий роль диафрагмы. В процессе электролиза рассол подают в анодную камеру, а из анодной камеры выводят раствор NaOH.
Электролизер, применяемый для получения магния, алюминия, щелочных и щелочно-земельных металлов, представляет собой футерованную огнеупорным материалом ванну, на дне которой находится расплавленный металл, служащий катодом, аноды же в виде блоков располагают над слоем жидкого металла. В процессах мембранного получения хлора, в электросинтезе используют электролизеры фильтр-прессного типа, собранные из отдельных рам, между которыми помещены ионообменные мембраны.
По характеру подключения к источнику питания различают монополярные и биполярные электролизеры. Монополярный электролизер состоит из одной электролитической ячейки с электродами одной полярности, каждый из которых может состоять из нескольких элементов, включенных параллельно в цепь тока. Биполярный электролизер имеет большое число ячеек (до 100-160), включенных последовательно в цепь тока, причем каждый электрод, за исключением двух крайних, работает одной стороной как катод, а другой как анод. Монополярные электролизеры обычно рассчитаны на большой ток и малые напряжения, биполярные - на сравнительно небольшой ток и высокие напряжения. Современные электролизеры допускают высокую токовую нагрузку: монополярные до 400-500 кА, биполярные - эквивалентную 1600 кА.
Электролиз и сферы его применения.
Ведение 3
Теоретическое обоснование процессов электролиза. 5
Применение электролиза в промышленности 8
Производство хлора и едкого натрия при помощи электролиза. 10
Заключение 12
Введение
Электролиз
– это совокупность процессов, протекающих
в растворе или расплаве электролита,
при пропускании через него электрического
тока. Электролиз является одним из
важнейших направлений в электрохимии.
Еще
в начале позапрошлого столетия было
установлено, что при прохождении
электрического тока через водные
растворы солей происходят химические
превращения, приводящие к образованию
новых веществ. В результате этого, в
начале прошлого века возникло научное
направление по изучению электрохимических
процессов в растворах и расплавах
веществ – электрохимия. К концу
семидесятых годов оно разделилось на
два самостоятельных раздела – ионику,
изучающую явления электропроводности
и движения заряженных частиц под
воздействием электрического поля, и
электродику, изучающую явления
происходящие непосредственно на
поверхности электродов, когда через
границу электрод-раствор (расплав)
протекает электрический ток. Химические
превращения, происходящие при воздействии
электрического тока на вещества,
называются электролитическими.
Электролиз
представляет собой довольно сложную
совокупность процессов, к которым
относятся: миграция ионов (положительных
к катоду, отрицательных к аноду), диффузия
ионов, разряжающихся на электродах,
электрохимические реакции разряда
ионов, вторичные химические реакции
продуктов электролиза между собой, с
веществом электролита и электрода.
Актуальность
электролиза объясняется тем, что многие
вещества получают именно этим способом.
Например, такие металлы как никель,
натрий, чистый водород и другие, получают
только с помощью этого метода. Кроме
того с его помощью электролиза относительно
легко можно получить чистые металлы,
массовая доля самого элемента в которых
стремиться к ста процентам. В промышленности
алюминий и медь в большинстве случаев
получают именно электролизом. Преимущество
этого способа в относительной дешевизне
и простоте. Однако чтобы производство
было наиболее выгодным: с наименьшими
затратами электроэнергии и с наибольшим
выходом продукции, необходимо учитывать
различные факторы, влияющие на количество
и качество продуктов электролиза (сила
тока, плотность тока, температура
электролита, материал электродов и
др.).
На сегодняшний день большой
популярностью пользуются различные
предметы, покрытые драгоценными
металлами. (позолоченные или посеребренные
вещи).
К тому же металлические изделия
покрывают слоем другого металла
электролитическим способом с целью
защитить его от коррозии.
Таким образом,
исследование электрохимических
процессов, определение факторов, влияющих
на них, установление новых способов
использования процессов электролиза
в промышленных условиях сохранило свою
актуальность и востребованность в наши
дни.
Теоретическое обоснование процессов электролиза.
Электролиз
протекает только в тех средах, которые
проводят электрический ток. Способностью
проводить ток обладают также водные
растворы оснований и солей. Безводные
кислоты – очень плохие проводники, но
водные растворы кислот хорошо проводят
ток. Растворы кислот, оснований и солей
в других жидкостях в большинстве случаев
тока не проводят, но и осмотическое
давление таких растворов оказывается
нормальным, точно так же не проводят
тока водные растворы сахара, спирта,
глицерина и другие растворы с нормальным
осмотическим давлением.
Различные
отношения веществ к электрическому
току можно иллюстрировать следующим
опытом:
Соединим провода идущие от
осветительной сети, с двумя угольными
электродами. В один из проводов включим
электрическую лампу, позволяющую грубо
судить о наличии тока в цепи. Погрузим
теперь свободные концы электродов в
сухую поваренную соль или безводную
серную кислоту. Лампа не загорается,
т.к. эти вещества не проводят тока и цепь
остается не замкнутой. То же самое
происходит, если погрузить электроды
в стакан с чистой дистиллированной
водой. Но стоит только растворить в воде
немного соли или прибавить к ней
какой-нибудь кислоты или основания, как
лампа тотчас же начинает ярко светиться.
Свечение прекращается если опустить
электроды в раствор сахара или глицерина
и т.п.
Таким образом, среди растворов
способностью проводить ток обладают
преимущественно водные растворы кислот,
оснований и солей. Сухие соли, безводные
кислоты и основания (в твердом виде)
тока не проводят; почти не проводит тока
чистая вода, очевидно, что при растворении
в воде кислоты основания или соли
подвергаются каким-то глубоким изменениям,
которые и обуславливают электропроводность
получаемых растворов.
Электрический
ток, проходя через растворы, вызывает
в них, так же как и в расплавах, химические
изменения, выражающиеся в том, что из
растворов выделяются продукты разложения
растворенного вещества или растворителя.
Вещества, растворы которые проводят
электрический ток, получили названия
электролитов. Электролитами являются
кислоты, основания и соли.
Химический
процесс, происходящий при пропускании
тока через раствор электролита, называется
электролизом. Исследуя продукты,
выделяющиеся у электрода, при электролизе
кислот, оснований и солей, установили,
что у катодов всегда выделяются металлы
и водород, а у анода кислотные остатки
или гидроксильные группы, которые затем
подвергаются дальнейшим изменениям.
Таким образом, первичными продуктами
электролиза оказываются те же части
кислот, оснований и солей, которые при
реакциях обмена, не изменяются, переходят
из одного вещества в другое.
Теперь,
рассмотрим процесс электролиза
подробнее.
Через проводники первого
рода электричество переносится
электронами, а через проводники второго
рода-ионами. В тех местах электрической
цепи, где проводник первого рода граничит
с проводником второго рода, электроны
вступают во взаимодействие с
ионами-происходят электрохимические
процессы. Если эти процессы протекают
самопроизвольно, то система называется
химическим источником энергии. Если же
их протекание обусловлено подводом
электрической энергии извне, то происходит
электролиз.
Примером электролиза
может служить электролиз расплава
хлорида магния. При прохождении тока
через расплав MgCl 2
катионы магния по действием электрического
поля движутся к отрицательному электроду.
Здесь, взаимодействуя с приходящими по
внешней цепи электронами, они
восстанавливаются: Анионы хлора
перемещаются к положительному электроду,
и, отдавая избыточные электроны,
окисляются. При этом первичным процессом
является собственно электрохимическая
стадия-окисление ионов хлора, а
вторичным-связывание образующихся
атомов хлора в молекулы. Складывая
уравнения процессов, протекающих у
электродов, получим суммарное уравнение
окислительно-восстановительной реакции,
происходящей при электролизе расплава
MgCl 2:
Mg 2 +
2Cl-l=Mg + Cl 2
Эта
реакция не может протекать самопроизвольно;
энергия, необходимая для её осуществления,
поступает от внешнего источника тока.
Как
и в случае химического источника
электрической энергии, электрод, на
котором происходит восстановление,
называется катодом; электрод, на котором
происходит окисление, называется анодом.
Но при электролизе катод заряжен
отрицательно, а анод-положительно,
т.е. распределение знаков заряда
электродов противоположно тому, которое
имеется при работе гальванического
элемента. При электролизе химическая
реакция осуществляется за счёт энергии
электрического тока, подводимой извне,
в то время как при работе гальванического
элемента энергия самопроизвольно
протекающей в нем химической реакции
превращается в электрическую энергию.
На основании этого были выведены
следующие законы:
Первый закон Фарадея
В
1832 году Фарадей
установил, что масса M вещества,
выделившегося на электроде, прямо
пропорциональна электрическому заряду
Q, прошедшему через электролит:
если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент пропорциональности
называется
электрохимическим эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты .
Х![]() имическим
эквивалентом иона
называется отношение молярной массы A
иона к его
валентности
z. Поэтому электрохимический эквивалент
имическим
эквивалентом иона
называется отношение молярной массы A
иона к его
валентности
z. Поэтому электрохимический эквивалент
Где - постоянная Фарадея.
Первый закон Фарадея записывается в следующем виде:
![]()
где - молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося - оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, - сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), - время, в течение которого проводился электролиз, - постоянная Фарадея, - число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
|
Катионы активных металлов |
Катионы менее активных металлов |
Катионы неактивных металлов |
|
Li + , Cs + , Rb + , K + , Ba 2+ , Sr 2+ , Ca 2+ , Na + , Mg 2+ , Be 2+ , Al 3+ |
Mn 2+ , Cr 3+ , Zn 2+ , Ga 3+ , Fe 2+ , Cd 2+ , In 3+ , Tl + , Co 2+ , Ni 2+ , Mo 4+ , Sn 2+ , Pb 2+ |
Bi 3+ , Cu 2+ , Ag + , Hg 2+ , Pd 3+ , Pt 2+ , Au 3+ |
|
тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода |
В водном растворе восстанавливаются металлы (при малой концентрации катионов в растворе - металл и водород) |
Легко разряжаются и восстанавливается только металлы |
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
На аноде анионы окисляются.
На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй - с согласной.
Применение электролиза в
промышленности
Электролиз
широко применяется в различных отраслях
промышленности. В химической промышленности
электролизом получают такие важные
продукты как хлор и щелочи, хлораты и
перхлораты, надсерную кислоту и
персульфаты, перманганат калия,
органические соединения, химически
чистые водород, кислород, фтор и ряд
других ценных продуктов.
В цветной
металлургии электролиз используется
для рафинирования металлов, для извлечения
металлов из руд. Металлы, которые не
могут быть выделены из водных растворов
вследствие высокого отрицательного
потенциала получают в цветной металлургии
электролизом расплавленных сред, в
качестве которых служат соли этих
металлов, содержащие добавки различных
соединений, вводимые с целью понижения
температуры плавления расплава, повышения
электропроводности и т.д. К числу
металлов, получаемых электролизом
расплавленных сред относятся алюминий,
магний, цирконий, титан, уран, бериллий
и ряд других металлов.
Электролиз
применяют во многих отраслях машиностроения,
радиотехники, электронной, полиграфической
промышленности для нанесения тонких
покрытий металлов на поверхность изделий
для защиты их от коррозии, придания
декоративного вида, повышения
износостойкости, жаростойкости, получения
металлических копий.
Несмотря на
большое разнообразие электролитов,
электродов, электролизеров, имеются
общие проблемы технического электролиза.
К ним следует отнести перенос зарядов,
тепла, массы, распределение электрических
полей. Для ускорения процесса переноса
целесообразно увеличивать скорости
всех потоков и применять принудительную
конвекцию. Электродные процессы могут
контролироваться путем измерения
предельных токов.
Заключение
Исследование процессов электролиза растворов и расплавов электролитов не потеряло своей актуальности и в настоящее время, т.к. не только обогащает теоретические положения об этом достаточно сложно физико-химическом явлении, но и позволяет определить перспективные направления практического использования этого процесса с целью получения целевых продуктов с заданными свойствами и качествами.
Электролиз
широко используют в промышленности для
выделения и очистки металлов, получения
щелочей, хлора, водорода.
Алюминий,
магний, натрий, кадмий, кальций, бериллий,
титан получают только электролизом
расплавов, т.к. потенциалы их выделения
из водных растворов более отрицательны,
чем потенциал выделения водорода.
Очистку
меди, никеля, свинца проводят целиком
электрохимическим методом. Производство
фтора основано на электролизе расплавленной
смеси фторида калия и фтороводородной
кислоты, хлора – при электролизе водных
растворов или расплавов хлоридов.
Водород и кислород высокой степени
чистоты получают электролизом водных
растворов щелочей. Таким образом, с
помощью электролиза удается осуществлять
реакции окисления и восстановления с
большим выходом и высокой селективностью,
которые в обычных химических процессах
трудно достижимы.
Важной отраслью
применения электролиза является защита
металлов от коррозии: при этом
электрохимическим методом на поверхность
металлических изделий наносится тонкий
слой другого металла (хрома, серебра,
меди, никеля, золота) устойчивого к
коррозии.
Отличительной особенностью
электролиза растворов или расплавов
электролитов является возможность
протекания на электродах совокупности
конкурирующих химических реакций
окисления и восстановления. Оказывает
влияние на продукты электролиза и
материал электродов.
При электролизе
водных растворов электролитов
окислительно-восстановительные процессы
на катоде и аноде зависят от окислительной
способности катионов и характера аниона
электролита.
На основании проделанной
работы можно сделать следующие выводы.
Доклад ученицы 10 кл. "Б"
школы 1257
Масоловой Елены по теме:
Применение электролиза.
Сущность электролиза.
Электролиз это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод , а к положительному полюсу анод , после чего погружают их в электролизер с раствором или расплавом электролита.
Электроды, как правило, бывают металлические, но применяются и неметаллические, например графитовые (проводящие ток).
На поверхности электрода, подключенного к отрицательному полюсу источника постоянного тока (катоде), ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления. На положительном электроде (аноде) происходит отдача электронов, т. е. реакция окисления. Таким образом, сущность электролиза состоит в том, что на катоде происходит процесс восстановления, а на аноде процесс окисления.
В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т. п., так называемые вторичные процессы.
Металлические аноды могут быть: а) нерастворимыми или инертными (Pt, Au, Ir, графит или уголь и др.), при электролизе они служат лишь передатчиками электронов; б) растворимыми (активными); при электролизе они окисляются.
В растворах и расплавах различных электролитов имеются разноименные по знаку ионы, т. е. катионы и анионы , которые находятся в хаотическом движении. Но если в такой расплав электролита, например расплав хлорида натрия NaCl, опустить электроды и пропускать постоянный электрический ток, то катионы Na+ будут двигаться к катоду, а анионы Cl к аноду. На катоде электролизера происходит процесс восстановления катионов Na+ электронами внешнего источника тока:
Na + + e = Na 0
На аноде идет процесс окисления анионов хлора, причем отрыв избыточных электронов от Cl осуществляется за счет энергии внешнего источника тока:
Cl e = Cl 0
Выделяющиеся электронейтральные атомы хлора соединяются между собой, образуя молекулярный хлор: Cl + Cl = Cl 2 , который и выделяется на аноде.
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl > 2Na + + 2Cl электролиз > 2Na 0 + Cl 2 0
Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия химических окислителей и восстановителей. Меняя напряжение на электродах, можно создать почти любой силы окислители и восстановители, которыми являются электроды электролитической ванны или электролизера.
Известно, что ни один самый сильный химический окислитель не может отнять у фторид-иона F его электрон. Но это осуществимо при электролизе, например, расплава соли NaF. В этом случае на катоде (восстановитель) выделяется из ионного состояния металлический натрий или кальций:
Na + + e = Na 0
на аноде (окислитель) выделяется ион фтора F, переходя из отрицательного иона в свободное состояние:
F e = F 0 ; F 0 + F 0 = F 2 0
- Продукты, выделяющиеся на электродах, могут вступать между собой в химическое взаимодействие, поэтому анодное и катодное пространство разделяют диафрагмой.
Практическое применение электролиза.
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии , биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.).
Электролиз в гидрометаллургии
является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов.
Электролиз может осуществляться с растворимыми анодами - процесс электрорафинирования или с нерастворимыми - процесс электроэкстракции.
Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах.
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки . Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др.
Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми, либо переходят в электролит и удаляются.
Гальванотехника область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника пожразделяется на гальваностегию и гальванопластику.
- Гальваностегия (от греч. покрывать) это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера.
Перед покрытием изделия необходимо его поверхность тщательно очистить (обезжирить и протравить), в противном случае металл будет осаждаться неравномерно, а кроме того, сцепление (связь) металла покрытия с поверхностью изделия будет непрочной. Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях. При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
- Гальванопластика получение путем электролиза точных, легко отделяемых металлических копий относительно значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами.
С помощью гальванопластики изготовляют бюсты, статуи и т. д.
Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование "накладного" слоя никеля, серебра, золота и т. д.).
Кроме указанных выше, электролиз нашел применение и в других областях:
- получение оксидных защитных пленок на металлах (анодирование);
- электрохимическая обработка поверхности металлического изделия (полировка );
- электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
- очистка воды удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
- электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru//
Размещено на http://www.allbest.ru//
Муниципальное казённое общеобразовательное учреждение
«Средняя общеобразовательная школа №7»
Реферат по Физике на тему: «Применение электролиза»
Выполнила:
ученица 10 класса «А»
МКОУ «СОШ №7»
Солодовникова Дарья
Руководитель:
Яковлева Вера Егоровна
Изобильный,2017
Введение
Электролиз (от греч. «лизис» - разложение, растворение, распад) - это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки - это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.(рис.1)Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна - катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Рафинирование (очистка) металлов
В электротехнике благодаря хорошей электропроводимости наиболее широкое применение как проводниковый материал имеет медь. Медные руды, кроме меди, содержат много примесей, таких, как, например, железо, сера, сурьма, мышьяк, висмут, свинец, фосфор и т. п. Процесс получения меди из руды заключается в следующем. Руду измельчают и обжигают в особых печах, где некоторые примеси выгорают, а медь переходит в окись меди, которую снова плавят в печах вместе с углем. Происходит восстановительный процесс, и получают продукт, называемый черной медью, с содержанием меди 98--99%. Медь, идущая на нужды электротехники, должна быть наиболее чистой, так как всякие примеси уменьшают электропроводимость меди. Такая медь получается из черной меди путем рафинирования ее электрическим способом. Неочищенная медь подвешивается в качестве анода в ванну с раствором медного купороса. Катодом служит лист чистой меди. При пропускании через ванну электрического тока медь с анода переходит в раствор, а оттуда осаждается на катод. Электролитическая медь содержит до 99,95% меди. Медь в электротехнике применяется для изготовлений изолированных проводов, кабелей, обмоток электрических машин и трансформаторов, медных полос, лент, коллекторных пластин, деталей машин и аппаратов.
Аналогичным способом получают и другие чистые металлы - никель, свинец, золото Второе место после меди в электротехнике занимает алюминий. Сырьем для получения алюминия служат бокситы, состоящие из окиси алюминия (до 70%), окиси кремния и окиси железа. В результате обработки бокситов щелочью получается продукт, называемый глиноземом (Аl2O3).Глинозем с некоторыми добавлениями (для снижения температуры плавления) загружается в огнеупорную печь, стенки и дно которой выложены угольными пластинами, соединенными с отрицательным полюсом источника напряжения. Через крышку печи проходит угольный стержень, который служит анодом. Сначала опускают угольный анод, в результате чего возникает электрическая дуга, которая расплавляет глинозем. В дальнейшем происходит электролиз расплавленной массы. Чистый алюминий скапливается на дне сосуда, откуда его выливают в формы. Процентное содержание алюминия в металле достигает 99,5%. Для получения алюминия требуется большое количество электроэнергии. Поэтому алюминиевые заводы строятся около больших гидроэлектростанций с дешевой электроэнергией. Алюминий в электротехнике употребляется для изготовления проводов, кабелей, получения некоторых сплавов.
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название - медный купорос) и опускают две пластины: анод - толстую пластину из неочищенной меди и катод - тонкий лист из чистой меди. При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы - никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для
предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Электрофорез
Электрофорез (от греч. «форезис» - перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств,скорость которого можно регулировать,
изменяя силу тока.
Извлечение металлов
Извлечение металлов первой и второй групп периодической системы осуществляется с помощью электролиза из расплавленных галогенидов этих металлов. Например, натрий получают электролизом расплавленного хлорида натрия в электролизере Даунса. Магний получают электролизом хлорида магния, который в свою очередь получают из доломита и морской воды.
Анодирование (анодное оксидирование)
электролиз оксидирование анодирование
Анодирование - способ получения оксидной пленки в жидких либо твердых электролитах.
При анодировании поверхность металла, которая окисляется, имеет положительный потенциал.
Анодирование применяется для получения защитных и декоративных слоев на поверхностях различных металлов и сплавов.
Анодное оксидирование наиболее часто применяется для получения покрытия на алюминии и его сплавах.
Слои, полученные на алюминии, обладают защитными, изоляционными, износостойкими, декоративными свойствами.
Плазменные методы оксидирования
Плазменное оксидирование проводят при низких температурах в плазме, содержащей кислород. Плазма образуется при помощи разрядов постоянного тока, СВЧ, ВЧ разрядов.Такое оксидирование применяется для получения оксидных слоев на поверхности кремния иполупроводниковых соединениях.
Также плазменным оксидированием повышают светочувствительность серебряно-цезиевых фотокатодов
Микродуговое оксидирование - метод получения многофункциональных оксидных слоев.
Данный способ позволяет наносить слои с высокими защитными, коррозийными, теплостойкими,изоляционными, декоративными свойствами. Внешний вид покрытия напоминает керамику.
Процесс микродугового оксидирования в большинстве случаев проводится в слабощелочных электролитах приподаче импульсного, либо переменного тока.
Оксидный слой приблизительно формируется на 70% вглубь основного металла.Толщина покрытия составляет около 200 - 250 мкм.Микродуговое оксидирование позволяет получать покрытия на деталях со сложным рельефом.Применяемые электролиты экологичны и не оказывают вредного влияния на окружающую среду.Применяется для формирования покрытий на магниевых и алюминиевых сплавах.
Полирование металлических изделий
Электрохимическая полировка поверхностей производится в электролитических растворах. Анодом в этом случае выступает изделие, которое погружается в ванну с электролитом. Под влиянием электрического тока происходит растворение металлов и образуется оксидная пленка небольшой толщины. Интенсивность процесса регулируется изменением плотности тока и напряжения.Состав электролита, его температура и режим полирования определяются в зависимости от металла, размеров и конфигурации изделия. Главное требование - устойчивость электролита и его способность сформировать защитную пленку с высоким сопротивлением электрическому напряжению.
Для изделий из черных металлов используются растворы с содержанием серной и фосфорной кислот, медные, латунные и стальные поверхности полируются в ортофосфорных электролитах, алюминий - в кислых и щелочных растворах, драгоценные металлы (серебро и золото) - в растворах с содержанием тиомочевины.
Электрохимическое окрашивание изделий из цветных металлов и их сплавов.?
Пассивируя металл, т. е. создавая оксидные или солевые пленки, можно проводить окраску или тонирование металлов. Толщина таких пленок соизмерима с длиной волны видимого света, поэтому цвет тонированной поверхности зависит от толщины покрытияи цвета металла. Для химического оксидирования с целью окраски широко используютперсульфатный раствор, а для электрохимического -- изделие делают анодом. В последнем случае говорят, что окрашивание проводят путем анодирования. Тонированию чаще всего подвергают изделия из меди и ее сплавов, а также из алюминия, олова, никеля.
Заключение
Актуальность электролиза объясняется тем, что многие вещества получают именно этим способом Получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) Получение металлов(литий, натрий, калий, бериллий, магний, цинк, алюминий, медь и т.д.) Очистка металлов (медь, серебро,…) Получение металлических сплавов Получение гальванических покрытий Обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка) Получение органических веществ,электродиализ и обессоливание воды,нанесение пленок при помощи электрофореза.
Список литературы
1.Новошинский, Н.С. Новошинская.Химия
2. Г. Я. Мякишев, Б. Б. Буховцев Н.Н. Сотский.Физика 10 класс
Приложение
рис 5Размещено на Allbest.ru
...Подобные документы
Получение экспериментальных образцов матричных платформ оксида алюминия с упорядоченной структурой сквозной пористости при использовании раствора щавелевой кислоты и двухстадийного потенциостатического режима анодирования при заданных температурах.
реферат , добавлен 25.06.2010
Метод осаждения определяемого элемента путем электролиза на предварительно взвешенном электроде. Требования к электродам, применяемым в электрогравиметрии. Подчинение законам Фарадея. Электрохимическая поляризация. Электролиз в кулонометрической ячейке.
реферат , добавлен 24.01.2009
Условия, влияющие на самоорганизацию наночастиц. Свойства нанокристаллического магния, титана, их применение. Принцип работы наноразмерного электронного выключателя. Характеристика мономеров биомакромолекул: белков, нуклеиновых кислот и полисахаридов.
контрольная работа , добавлен 20.12.2014
Историческая справка. Положение меди в периодической системе Д.И. Менделеева. Распространение в природе. Получение, физические свойства, применение. Метод электролитического осаждения. Построение физико-математической модели. Определение характеристик.
курсовая работа , добавлен 24.12.2005
Свойства нанокристаллических порошковых материалов на основе тугоплавких соединений. Высокоэнергетические методы консолидации порошковых наноматериалов. Получение спеканием и свойства плотных образцов карбонитрида титана c нанокристаллической структурой.
реферат , добавлен 26.06.2010
Электрический ток в металлах, полупроводниках и электролитах. Зонная модель электронной проводимости металлов. Квантово-механическое объяснение сверхпроводимости в полупроводниках. Электрический ток в электролитах. Применение электролиза на производстве.
презентация , добавлен 13.02.2016
Растворимость водорода в аллотропической форме титана. Влияние водорода на механические свойства титана высокой чистоты. Классификация сплавов титана по легирующим элементам. Сущность механизма и признаки водородного охрупчивания титановых сплавов.
реферат , добавлен 15.01.2011
Электроток в растворе, упорядоченное движение заряженных частиц, электролитическая диссоциация. Направленное движение электронов источника электрической энергии. Электролитическое промышленное получение алюминия, гальваностегия и активность металлов.
презентация , добавлен 26.03.2012
Открытия явления электролиза. Сравнение первых гальванических элементов с современными батарейками ведущих фирм мира. Процесс электролиза в расплавах электролитов. Механизм электрического тока в жидких проводниках. Основные гальванические элементы.
отчет по практике , добавлен 27.05.2010
Принцип действия и разновидности лазеров. Основные свойства лазерного луча. Способы повышения мощности лазерного излучения. Изучение особенностей оптически квантовых генераторов и их излучения, которые нашли применение во многих отраслях промышленности.
Электролиз нашел широкое применение в технике, например в металлургии, химической промышленности и т. д.
1. Покрытие металлов слоем другого металла при помощи электролиза (гальваностегия).
Для предохранения металлов от окисления, а также для придания изделиям прочности и лучшего внешнего вида их покрывают тонким слоем благородных металлов
(золото, серебро) или малоокисляющимися металлами (хром, никель).
Предмет, подлежащий
гальваническому покрытию, тщательно очищают, полируют и обезжиривают, после
чего погружают в качестве катода в гальваническую ванну. Электролитом является
раствор соли металла, которым осуществляется покрытие. Анодом служит пластина
из того же металла. На рис. 45 изображена ванна для никелирования. Электролитом
служит водный раствор вещества, содержащего никель (например, сернокислый
никель NiS04), катодом является предмет, подвергающийся покрытию. Величина
тока, пропускаемого через ванну, должна соответствовать величине t покрываемой
поверхности. Для равномерного покрытия
предмета его помещают между двумя анодными пластинами. После покрытия предмет
вынимают из ванны, сушат и полируют.
2. Получение копий с предметов при помощи электролиза (гальванопластика).
Для получения копий с металлических предметов (монет, медалей, барельефов и т. п.) делают слепки из какого-нибудь пластичного материала (например, воска). Для придания слепку электропроводимости его покрывают графитовой пылью, погружают в ванну в качестве катода и получают на нем слой металла нужной толщины. Затем путем нагревания удаляют воск.
Производство патефонных пластинок основано на применении гальванопластики (рис. 40). Восковая пластина с нанесенной на ней записью, опыленная для электропроводимости золотом, погружается в раствор медного купороса в качестве катода. Медный анод поддерживает концентрацию раствора постоянной. Полученный металлический рельефный негативный отпечаток служит для штампования из нагретой пластмассы большого числа патефонных пластинок.
Гальванопластика применяется во многих отраслях промышленности, в том числе в полиграфии. Процесс гальванопластики был разработан в 5836 г. русским академиком Борисом Семеновичем Якоби (1801-1874). Б. С. Якоби известен своими многочисленными работами в области электротехники. Он является изобретателем первого электродвигателя с непосредственным вращением вала, коллектора для выпрямления тока, пишущих телеграфных аппаратов, а также первого в мире буквопечатающего телеграфного аппарата; им впервые (в 1838 г.) осуществлено движение лодки при помощи электрической энергии.
Якоби созданы приборы для измерения электрического сопротивления, изготовлен эталон сопротивления, сконструирован вольтметр.
3. Рафинирование (очистка) металлов.
В электротехнике благодаря хорошей электропроводимости наиболее широкое применение как проводниковый материал имеет

медь. Медные руды, кроме меди, содержат много примесей, таких, как, например, железо, сера, сурьма, мышьяк, висмут, свинец, фосфор и т. п. Процесс получения меди из руды заключается в следующем. Руду измельчают и обжигают в особых печах, где некоторые примеси выгорают, а медь переходит в окись меди, которую снова плавят в печах вместе с углем. Происходит восстановительный процесс, и получают продукт,
называемый черной медью, с содержанием меди 98-99%. Медь, идущая на нужды электротехники, должна быть наиболее чистой, так как всякие примеси уменьшают электропроводимость меди. Такая медь получается из черной меди путем рафинирования ее электрическим способом.
Неочищенная медь подвешивается в качестве анода в ванну с раствором медного купороса (рис. 47). Катодом служит лист чистой меди. При пропускании через ванну электрического тока медь с анода переходит в раствор, а оттуда осаждается на катод. Электролитическая медь содержит до 99,95% меди.
Медь в электротехнике применяется для изготовлений голых к изолированных проводов, кабелей, обмоток электрических машин и трансформаторов, медных полос, лент, коллекторных пластин, деталей машин и аппаратов.
Второе место после меди в электротехнике занимает алюминий. Сырьем для получения алюминия служат бокситы, состоящие из окиси алюминия (до 70%), окиси кремния и окиси железа. В результате обработки бокситов щелочью получается продукт, называемый глиноземом (Аl 2 O 3).
Глинозем с некоторыми добавлениями (для снижения температуры плавления) загружается в огнеупорную печь, стенки и дно которой выложены угольными пластинами, соединенными с отрицательным полюсом источника напряжения. Через крышку печи проходит угольный стержень, который служит анодом. Сначала опускают угольный анод, в результате чего возникает электрическая дуга, которая расплавляет глинозем. В дальнейшем происходит электролиз расплавленной массы. Чистый алюминий скапливается на дне сосуда, откуда его выливают в формы. Процентное содержание алюминия в металле достигает 99,5%. Для получения алюминия требуется большое количество электроэнергии. Поэтому алюминиевые заводы строятся около больших гидроэлектростанций с дешевой электроэнергией.
Алюминий в электротехнике употребляется для изготовления проводов, кабелей, получения некоторых сплавов.