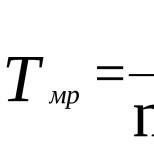Сгр на кормовые добавки. Срок выполнения услуги. Документ с данными о производстве кормовой добавки
Приказ Минсельхоза РФ от 1 апреля 2005 г. N 48 «Об утверждении Правил государственной регистрации лекарственных средств для животных и кормовых добавок» (с изменениями от 27 декабря 2005 г., 8 августа 2006 г.)
В целях реализации требований Закона Российской Федерации от 14 мая 1993 г. N 4979-1 «О ветеринарии» (Ведомости Съезда народных депутатов Российской Федерации и Верховного Совета Российской Федерации, 1993, N 24, ст. 857; Собрание законодательства Российской Федерации, 2002, N 1 (ч. I), ст. 2; 2004, N 27, ст. 2711; 2004, N 35, ст. 3607) и Федерального закона от 22 июня 1998 г. N 86-ФЗ «О лекарственных средствах» (Собрание законодательства Российской Федерации, 1998, N 26, ст. 3006; 2000, N 2, ст. 126; 2002, N 1 (ч. I), ст. 2; 2003, N 2, ст. 167; 2003, N 27 (ч. I), ст. 2700; 2004, N 35, ст. 3607) приказываю:
1. Утвердить Правила государственной регистрации лекарственных средств для животных и кормовых добавок (прилагаются).
2. Россельхознадзору осуществлять государственную регистрацию лекарственных средств для животных и кормовых добавок в соответствии с указанными Правилами.
3. Контроль за выполнением приказа возложить на заместителя Министра С.Г. Митина, Министр А.В. Гордеев Зарегистрировано в Минюсте РФ 14 апреля 2005 г. Регистрационный N 6510 Приказом Минсельхоза РФ от 8 августа 2006 г. N 222 в настоящее приложение внесены изменения См. текст приложения в предыдущей редакции Приложение к приказу Минсельхоза РФ от 1 апреля 2005 г. N 48
Правила государственной регистрации лекарственных средств для животных и кормовых добавок (с изменениями от 27 декабря 2005 г., 8 августа 2006 г.)
1. Правила государственной регистрации лекарственных средств для животных и кормовых добавок (далее - Правила) разработаны в соответствии с Законом Российской Федерации от 14 мая 1993 г. N 4979-1 «О ветеринарии», Федеральным законом от 22 июня 1998 г. N 86-ФЗ «О лекарственных средствах», Положением о Министерстве сельского хозяйства Российской Федерации, утвержденным постановлением Правительства Российской Федерации от 24 марта 2006 г. N 164 и Положением о Федеральной службе по ветеринарному и фитосанитарному надзору, утвержденным постановлением Правительства Российской Федерации от 30 июня 2004 г. N 327.
2. Правила устанавливают единую процедуру государственной регистрации отечественных и зарубежных лекарственных средств для животных (далее - лекарственные средства) и кормовых добавок (далее - добавки), за исключением кормовых добавок, полученных из генно-инженерно-модифицированных организмов.
3. Установленный Правилами порядок государственной регистрации лекарственных средств и добавок является обязательным для выполнения юридическими и физическими лицами, осуществляющими производство, реализацию, использование, а также ввоз на территорию Российской Федерации лекарственных средств и добавок.
4. Государственной регистрации подлежат: новые лекарственные средства; новые добавки; новые комбинации зарегистрированных ранее лекарственных средств; новые комбинации зарегистрированных ранее добавок; лекарственные средства, зарегистрированные ранее, но произведенные в других лекарственных формах, или с новой дозировкой, или с другим составом вспомогательных веществ; добавки, зарегистрированные ранее, но произведенные в других формах, или с новой дозировкой, или с другим составом вспомогательных веществ; воспроизведенные лекарственные средства; воспроизведенные добавки.
5. Государственную регистрацию лекарственных средств и добавок проводит Россельхознадзор на основании заключения Федерального государственного учреждения «Всероссийский государственный Центр контроля качества и стандартизации лекарственных средств для животных и кормов» (далее - ФГУ «ВГНКИ») в течение шести месяцев со дня подачи регистрационных документов и данных, предусмотренных настоящими Правилами.
6. Для государственной регистрации лекарственного средства или добавки Заявитель представляет в Россельхознадзор следующие регистрационные документы и данные: заявление о государственной регистрации лекарственного средства или добавки (приложение к Правилам); юридический адрес организации - производителя лекарственного средства или добавки; названия лекарственного средства или добавки, включая международное непатентованное название, научное название на латинском языке, основные синонимы; оригинальное название лекарственного средства или добавки, если оно зарегистрировано как торговый знак в соответствии с законодательством Российской Федерации о торговых знаках, знаках обслуживания и наименованиях мест происхождения товаров; перечень компонентов, входящих в состав лекарственного средства или добавки, их количество; инструкцию по применению лекарственного средства или добавки, оформленную в соответствии с требованиями Федерального закона от 22 июня 1998 г. N 86-ФЗ «О лекарственных средствах»; сертификат качества лекарственного средства или добавки; данные о производстве лекарственного средства или добавки; методы контроля качества лекарственного средства или добавки; результаты доклинических исследований лекарственного средства или добавки; результаты фармакологических и токсикологических исследований лекарственного средства или добавки; результаты ветеринарных исследований; образцы лекарственного средства или добавки для проведения экспертизы его качества; предложения по цене лекарственного средства или добавки; документы, подтверждающие регистрацию лекарственного средства или добавки, если оно зарегистрировано вне пределов Российской Федерации.
7. Экспертиза лекарственных средств и добавок осуществляется ФГУ «ВГНКИ»* по соглашению сторон. Экспертиза лекарственных средств и добавок включает: а) специализированную оценку регистрационных документов с целью составления мотивированного вывода об эффективности, безопасности и качестве лекарственного средства или добавки; б) исследование образцов лекарственного средства или добавки на соответствие требованиям нормативно-технической документации по контролю качества лекарственного средства или добавки и воспроизводимости предложенных методов исследований.
8. По результатам экспертизы ФГУ «ВГНКИ» направляет в Россельхознадзор мотивированное заключение о возможности или о невозможности регистрации лекарственного средства или добавки.
9. По результатам рассмотрения документов и на основании экспертного заключения ФГУ «ВГНКИ» Россельхознадзор принимает решение о регистрации или о мотивированном отказе в регистрации лекарственного средства или добавки. В случае представления неполного комплекта регистрационных документов и данных, а также при возникновении сомнений в качестве и достоверности представленных материалов процедура государственной регистрации приостанавливается на срок, не превышающий 3 месяцев. В случае непредставления Заявителем недостающих материалов о лекарственном средстве или добавке в установленные сроки, а также при выявлении недостоверности представленных материалов в государственной регистрации лекарственного средства или добавки отказывается. На основании решения о регистрации Россельхознадзор выдает Заявителю документ установленного образца о государственной регистрации на каждую форму (лекарственную) лекарственного средства или добавки сроком на 5 лет, утвержденную инструкцию по применению лекарственного средства или добавки и согласованную нормативно-техническую документацию.
10. Регистрация лекарственного средства или добавки может быть приостановлена при выявлении у лекарственного средства или добавки побочного действия или при получении о нем данных, которые не были известны на момент регистрации.
11. В течение срока действия документа о государственной регистрации Заявитель обязан сообщать о любых изменениях, которые предполагается внести в регистрационные документы, и предоставлять исчерпывающую информацию о причинах этих изменений и их влиянии на эффективность, безопасность и качество зарегистрированного лекарственного средства или добавки, в том числе об изменении технологии и места производства.
12. За шесть месяцев до окончания срока действия документа о государственной регистрации Заявитель вправе подать заявление на регистрацию лекарственного средства или добавки на новый срок.
13. Зарегистрированное лекарственное средство или добавка вносится в государственный реестр лекарственных средств для животных и кормовых добавок.
14. Россельхознадзор в течение 10 дней после государственной регистрации лекарственного средства или добавки направляет в Минсельхоз России для внесения в государственный реестр лекарственных средств для животных и кормовых добавок следующие сведения: а) название лекарственного средства или добавки; б) форма лекарственного средства или добавки; в) показания (область) применения лекарственного средства или добавки; г) Заявитель (с указанием страны или субъекта Российской Федерации, в котором зарегистрирован Заявитель); д) организация-производитель (с указанием страны или субъекта Российской Федерации, в котором зарегистрирована организация-производитель); е) регистрационный номер лекарственного средства или добавки; ж) учетная серия Заявителя (организации-производителя); з) дата регистрации лекарственного средства или добавки; и) срок действия регистрации лекарственного средства или добавки.
15. В случае необходимости внесения изменений в государственный реестр лекарственных средств для животных и кормовых добавок Россельхознадзор направляет соответствующую информацию в Минсельхоз России в порядке, установленном пунктом 14 Правил.
16. Минсельхоз России вносит в государственный реестр лекарственных средств для животных и кормовых добавок поступившие сведения не позднее, чем через 5 дней с момента их получения. Не позднее, чем через 5 дней после внесения поступивших сведений в государственный реестр лекарственных средств для животных и кормовых добавок, Минсельхоз России направляет в Россельхознадзор выписку из государственного реестра лекарственных средств для животных и кормовых добавок для выдачи ее Заявителю.
17. Информация, содержащаяся в государственном реестре лекарственных средств для животных и кормовых добавок, является открытой для всеобщего ознакомления на сайте Минсельхоза России в сети Интернет, а также подлежит опубликованию Минсельхозом России.______________________________ * Статья 16 Закона Российской Федерации от 14 мая 1993 г. N 4979-1 «О ветеринарии». Приказом Минсельхоза РФ от 27 декабря 2005 г. N 236 настоящие Правила дополнены приложением Приложение к Правилам государственной регистрации лекарственных средств для животных и кормовых добавок (ОБРАЗЕЦ) ЗАЯВЛЕНИЕ прошу зарегистрировать в Российской Федерации лекарственное средство для животных/кормовую добавку отечественного (зарубежного) производства _____________________________________________________________________________________ (торговое название продукции - лекарственного средства для животных/кормовой добавки) 1. Заявитель ________________________________________________________________________ (полное наименование юридического лица в соответствии с учредительными документами) 2. Местонахождение Заявителя ________________________________________________________ _____________________________________________________________________________________ (адрес места нахождения, телефон/факс, ИНН юридического лица) 3. Представитель Заявителя _____________________________________________________________________________________ (Ф.И.О., адрес, телефон, ИНН (при наличии), доверенность - дата/N) 4. Сведения о продукции (лекарственном средстве для животных/кормовой добавке): 4.1. Название продукции _____________________________________________________________ (торговое название/оригинальное название на русском языке, научное название на _____________________________________________________________________________________ латинском языке, включая международное непатентованное название лекарственного средства для животного/кормовой добавки) 4.2. Форма выпуска __________________________________________________________________ 4.3. Состав _________________________________________________________________________ (компонентный состав продукции по фармгруппе, действующее вещество) _____________________________________________________________________________________ (наличие компонентов растительного/животного происхождения, не содержащих ГМО) 4.4. Назначение _____________________________________________________________________ 5. Наличие патента, его номер, владелец _____________________________________________ 6. Разработчик продукции ____________________________________________________________ (наименование юридического лица, адрес места нахождения, телефон) _____________________________________________________________________________________ 7. Производитель продукции __________________________________________________________ (адрес места нахождения, телефон) _____________________________________________________________________________________ (наименование фирмы-производителя/наименование зарубежного производителя) 8. Сведения о регистрации продукции _________________________________________________ _____________________________________________________________________________________ (номер и дата регистрации в Российской Федерации, дата окончания срока регистрации, регистрация за рубежом) Заявка подана: « « ______________ 2005 г. ___________________________________________ (подпись Заявителя/представителя Заявителя) ___________________________________________ (Ф.И.О., занимаемая должность) Печать
Приказ Минсельхоза РФ от 1 апреля 2005 г. N 48
"Об утверждении Правил государственной регистрации лекарственных средств для животных и кормовых добавок"
С изменениями и дополнениями от:
В целях реализации требований Закона Российской Федерации от 14 мая 1993 г. N 4979-1 "О ветеринарии" (Ведомости Съезда народных депутатов Российской Федерации и Верховного Совета Российской Федерации, 1993, N 24, ст. 857; Собрание законодательства Российской Федерации, 2002, N 1 (ч. I), ст. 2; 2004, N 27, ст. 2711; 2004, N 35, ст. 3607) и Федерального закона от 22 июня 1998 г. N 86-ФЗ "О лекарственных средствах" (Собрание законодательства Российской Федерации, 1998, N 26, ст. 3006; 2000, N 2, ст. 126; 2002, N 1 (ч. I), ст. 2; 2003, N 2, ст. 167; 2003, N 27 (ч. I), ст. 2700; 2004, N 35, ст. 3607) приказываю:
1. Утвердить Правила государственной регистрации лекарственных средств для животных и кормовых добавок (прилагаются).
2. Россельхознадзору осуществлять государственную регистрацию лекарственных средств для животных и кормовых добавок в соответствии с указанными Правилами .
3. Контроль за выполнением приказа возложить на заместителя Министра С.Г. Митина.
|
А.В. Гордеев |
Регистрационный N 6510
Устанавливается единая процедура государственной регистрации отечественных и зарубежных лекарственных средств для животных и кормовых добавок, за исключением кормовых добавок, полученных из генно-инженерно-модифицированных организмов.
Государственную регистрацию осуществляет Россельхознадзор на основании заключения ФГУ "Всероссийский государственный Центр контроля качества и стандартизации лекарственных средств для животных и кормов" в течение шести месяцев со дня подачи регистрационных документов. Зарегистрированное лекарственное средство или добавка вносится в государственный реестр лекарственных средств и кормовых добавок.
Установленный порядок государственной регистрации является обязательным для выполнения юридическими и физическими лицами, осуществляющими производство, реализацию, использование, а также ввоз на территорию РФ лекарственных средств и добавок.
Приказ Минсельхоза РФ от 1 апреля 2005 г. N 48 "Об утверждении Правил государственной регистрации лекарственных средств для животных и кормовых добавок"
Регистрационный N 6510
Настоящий приказ вступает в силу по истечении 10 дней после дня его официального опубликования
Российской Федерации от 14 мая 1993 г. N 4979-1 "О ветеринарии", Федерального закона от 22 июня 1998 г. N 86-ФЗ "О лекарственных средствах", а также в соответствии с Положением о Федеральной службе по ветеринарному и фитосанитарному надзору, утвержденным Постановлением Правительства Российской Федерации от 30 июня 2004 г. N 327, и Приказом Министерства сельского хозяйства Российской Федерации от 1 апреля 2005 г. N 48 "Об утверждении Правил государственной регистрации лекарственных средств для животных и кормовых добавок" приказываю:
РАССМОТРЕНИЯ ЗАЯВЛЕНИЙ О ГОСУДАРСТВЕННОЙ
РЕГИСТРАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЖИВОТНЫХ
ЗАЯВЛЕНИЕ Прошу зарегистрировать в Российской Федерации лекарственное средство для животных/кормовую добавку отечественного (зарубежного) производства __________________________________________________________________ (торговое название продукции - лекарственного средства для животных/кормовой добавки) 1. Заявитель __________________________________________________________________ (полное наименование юридического лица в соответствии с учредительными документами) 2. Местонахождение Заявителя _____________________________________ (адрес места нахождения, __________________________________________________________________ телефон/факс, ИНН юридического лица) 3. Представитель Заявителя __________________________________________________________________ (Ф.И.О., адрес, телефон, ИНН, доверенность - дата/N) 4. Сведения о продукции (лекарственном средстве для животных/кормовой добавке): 4.1. Название продукции __________________________________________ (торговое название/оригинальное название __________________________________________________________________ на русском языке, научн. назв. на латинском яз., включая международное непатентованное название лекарственного средства для животного/кормовой добавки) 4.2. Форма выпуска _______________________________________________ 4.3. Состав ______________________________________________________ (компонентный состав продукции по фарм. группе, действующее вещество) __________________________________________________________________ (наличие компонентов растительного/животного происхождения, не содержащих ГМО) 4.4. Назначение __________________________________________________ 5. Наличие патента, его номер, владелец __________________________ 6. Разработчик продукции _________________________________________ (наименование юридического лица, __________________________________________________________________ адрес места нахождения, телефон) 7. Производитель продукции _______________________________________ (адрес места нахождения, телефон) __________________________________________________________________ (наименование фирмы-производителя/наименование зарубежного производителя на английском языке) 8. Сведения о регистрации продукции ______________________________ __________________________________________________________________ (номер и дата регистрации в Российской Федерации, дата окончания срока регистрации, регистрация за рубежом) Заявка подана: "__" _______________ 2005 г. ____________________________________ (подпись Заявителя/представителя Заявителя) ____________________________________ (Ф.И.О., занимаемая должность) Печать
Приложение N 2
к Порядку рассмотрения заявлений
о государственной регистрации
лекарственных средств для животных
и кормовых добавок
ТРЕБОВАНИЯ
К ОФОРМЛЕНИЮ ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО СРЕДСТВА ИЛИ КОРМОВОЙ ДОБАВКИ
1. Название лекарственного средства или добавки русское и латинское. Синонимы.
2. Состав. Содержание и химическое название действующего(их) и вспомогательного(ных) веществ лекарственного средства или добавки.
3. Форма (лекарственная). Внешний вид. Физические и химические свойства (агрегатное состояние, цвет, прозрачность, растворимость в воде и других растворителях).
4. Форма выпуска. Фасовка, упаковка, маркировка, условия хранения, транспортировки и срок годности лекарственного средства или добавки.
II. Фармакологические (биологические) свойства
5. Механизм действия лекарственного средства или добавки.
6. Основные фармакологические, биологические и другие свойства лекарственного средства или добавки (биодоступность, токсичность, фармакокинетика, выделение из организма, иммуногенность, реактогенность, питательность и др.).
III. Порядок применения
7. Показания к применению (перечислить).
8. Порядок и условия применения лекарственного средства или добавки с указанием вида животных, способа, доз (разовая, суточная, кратность, курс), до или после кормления, диета при применении лекарственного средства или добавки и т.д.
9. Возможные побочные явления и осложнения. Меры предупреждения и лечения (антидоты, дезактивация, нейтрализация).
10. Совместимость с другими лекарственными средствами и добавками.
11. Противопоказания для применения.
12. Сроки возможного использования продуктов животноводства после применения лекарственного средства или добавки и в случае вынужденного убоя.
IV. Меры личной профилактики
1. Подана
Заявка подана в отдел надзора за оборотом лекарственных средств для ветеринарного применения
2. Направлена в ФГБУ ВГНКИ
Регистрационное досье и образцы направлены в ФГБУ для проведения регистрационных испытаний
3. Договор на регистрационные испытания
Между заявителем и ФГБУ ВГНКИ заключен договор на проведение регистрационных испытаний
4. Произведена оплата
Произведена оплата регистрационных испытаний в ФГБУ ВГНКИ
5. Регистрационные испытания
ФГБУ ВГНКИ проводит регистрационные испытания образцов
6. Подготовка экспертного заключения
На основании регистрационных испытаний, ФГБУ ВГНКИ готовит экспертное заключение
7.
Заявителю рекомендовано представить дополнительную информацию/внести изменения в документацию
8. Заключение ФГБУ ВГНКИ
По результатам испытаний ФГБУ дает заключение о возможности регистрации лекарственного средства/кормовой добавки
9. Документы переданы в Россельхознадзор
После проведения регистрационных испытаний в ФГБУ ВГНКИ, документы переданы на рассмотрение в "Отдел надзора за оборотом лекарственных средств для ветеринарного применения" Россельхознадзора
10. Согласование нормативных документов
Начальник управления ветеринарного надзора Россельхознадзора проводит согласование нормативно-технической документации и инструкций по применению
11. Документы отправлены на доработку
Заявителю рекомендуется внести изменения в нормативно-техническую документацию/инструкцию по применению
12. Утверждение документации
Заместитель руководителя Россельхознадзора утверждает нормативно-техническую документацию на лекарственное средство/кормовую добавку
13. Зарегистрировано / Внесено в реестр
Дата государственной регистрации лекарственного средства/кормовой добавки
14. Снято с регистрации
Заявка снята с регистрации по просьбе заявителя или по решению Россельхознадзора
15. Регистрация приостановлена
Процедура государственной регистрации приостановлена
16. Применение приостановлено
Применение приостановлено
17. Отказано в госрегистрации
По заключению комиссии экспертов отказано в государственной регистрации
18. Регистрация отменена
Регистрация отменена
19. Подтверждение госрегистрации
Подана заявка на подтверждение госрегистрации
20. Внесение изменений
Подана заявка на внесение изменений