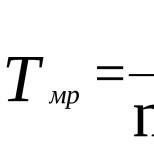Вступительное слово к книге С. Н. Князева
Антуан Лоран ЛАВУАЗЬЕ () () Исследовал кислород и создал кислородную теорию горения, пришедшую на смену флогистонной теории. Исследовал кислород и создал кислородную теорию горения, пришедшую на смену флогистонной теории.

Кислород – самый распространенный элемент на Земле В воздухе 21% (по объему), В воздухе 21% (по объему), в земной коре 49% (по массе), в земной коре 49% (по массе), в гидросфере 89% (по массе), в гидросфере 89% (по массе), в живых организмах до 65% массы. в живых организмах до 65% массы.

Физические свойства Агрегатное состояние - газ при обычных условиях. При очень низких температурах (-183°С) переходит в жидкое агрегатное состояние (голубая жидкость), а при еще более низких температурах (-219°С) становится твёрдым (синие снежные кристаллы). Агрегатное состояние - газ при обычных условиях. При очень низких температурах (-183°С) переходит в жидкое агрегатное состояние (голубая жидкость), а при еще более низких температурах (-219°С) становится твёрдым (синие снежные кристаллы). Цвет – бесцветный. Цвет – бесцветный. Запах - без запаха. Запах - без запаха. Растворимость в воде - плохо растворяется. Растворимость в воде - плохо растворяется. Тяжелее воздуха (М воздуха = 29 г/моль, а М О 2 = 32 г/моль. Тяжелее воздуха (М воздуха = 29 г/моль, а М О 2 = 32 г/моль.


Химические свойства Кислород очень сильный окислитель! Он окисляет многие вещества уже при комнатной температуре (медленное окисление) и тем более при нагревании или при горении вещества (быстрое окисление). Кислород очень сильный окислитель! Он окисляет многие вещества уже при комнатной температуре (медленное окисление) и тем более при нагревании или при горении вещества (быстрое окисление). В реакциях со всеми элементами (кроме фтора) кислород всегда ОКИСЛИТЕЛЬ. В реакциях со всеми элементами (кроме фтора) кислород всегда ОКИСЛИТЕЛЬ.

Реакции с металлами В результате реакции образуется оксид этого металла. Например, алюминий окисляется кислородом согласно уравнению: В результате реакции образуется оксид этого металла. Например, алюминий окисляется кислородом согласно уравнению: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 Другой пример. При опускании раскалённой железной проволоки в склянку с кислородом, проволока сгорает, разбрызгивая в стороны снопы искр - раскалённых частичек железной окалины Fe 3 O 4: t° 3Fe + 2O 2 Fe 3 O 4 t° 3Fe + 2O 2 Fe 3 O 4


Другие примеры реакций с неметаллами Горение серы в кислороде с образованием сернистого газа SO 2: t° S + O 2 SO 2 t° S + O 2 SO 2 Горение угля в кислороде с образованием углекислого газа: Горение угля в кислороде с образованием углекислого газа: t° С + О 2 СО 2 t° С + О 2 СО 2

Реакции с некоторыми сложными веществами В этом случае образуются оксиды элементов, из которых состоит молекула сложного вещества. В этом случае образуются оксиды элементов, из которых состоит молекула сложного вещества. Например, при обжиге сульфида меди (II) Например, при обжиге сульфида меди (II) t° 2CuS + 3O 2 2CuO + 2SO 2 t° 2CuS + 3O 2 2CuO + 2SO 2 образуются два оксида оксид меди (II) и оксид серы (IV). образуются два оксида оксид меди (II) и оксид серы (IV). При обжиге сульфидов образуется всегда оксид серы, валентность серы в котором равна IV. При обжиге сульфидов образуется всегда оксид серы, валентность серы в котором равна IV. Другой пример горение метана СН 4. Так как эта молекула состоит из атомов элементов углерода С и водорода Н, значит, образуется два оксида оксид углерода (IV) СО 2 и оксид водорода, то есть вода - Н 2 О: t° СН 4 + 2О 2 СО 2 + 2Н 2 О t° СН 4 + 2О 2 СО 2 + 2Н 2 О

Химическое взаимодействие вещества с кислородом называется реакцией окисления. Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения. Реакции горения веществ это примеры быстрого окисления, а вот гниение, ржавление и т.п. это примеры медленного окисления веществ кислородом Реакции горения веществ это примеры быстрого окисления, а вот гниение, ржавление и т.п. это примеры медленного окисления веществ кислородом
Получение кислорода (лабораторные способы) разложение воды электрическим током разложение воды электрическим током разложение пероксида водорода Н 2 О 2 под действием катализатора MnO 2 разложение пероксида водорода Н 2 О 2 под действием катализатора MnO 2 разложение перманганата калия KMnO 4 при нагревании. разложение перманганата калия KMnO 4 при нагревании.

Получение кислорода (промышленный способ) В промышленности для получения чистого кислорода используют перегонку жидкого воздуха, основанную на разных температурах кипения компонентов воздуха. Воздух охлаждают примерно до -200°С и затем медленно нагревают. При достижении температуры - 183°С из жидкого воздуха улетучивается кислород, остальные компоненты сжиженного воздуха при этой температуре остаются в жидком агрегатном состоянии. В промышленности для получения чистого кислорода используют перегонку жидкого воздуха, основанную на разных температурах кипения компонентов воздуха. Воздух охлаждают примерно до -200°С и затем медленно нагревают. При достижении температуры - 183°С из жидкого воздуха улетучивается кислород, остальные компоненты сжиженного воздуха при этой температуре остаются в жидком агрегатном состоянии.

Применение кислорода в строительстве и машиностроении в строительстве и машиностроении - для кислородно - ацетиленовой газосварки и газорезки металлов - для кислородно - ацетиленовой газосварки и газорезки металлов - для напыления и наплавки металлов в нефтедобыче в нефтедобыче - при закачке в пласт для повышения энергии вытеснения в металлургии и горнодобывающей промышленности в металлургии и горнодобывающей промышленности - при конвективном производстве стали, кислородном дутье в доменных печах, извлечение золота и руд, производстве ферросплавов, выплавке никеля, цинка свинца, циркония и др. цветных металлов - при конвективном производстве стали, кислородном дутье в доменных печах, извлечение золота и руд, производстве ферросплавов, выплавке никеля, цинка свинца, циркония и др. цветных металлов - при прямом восстановлении железа - при прямом восстановлении железа - при огневой зачистке в литейном производстве - при огневой зачистке в литейном производстве - при огневом бурении твердых пород

Применение кислорода в медицине в медицине - в оксибарокамерах - в оксибарокамерах - при заправке кислородных масок, подушек и т.д. - при заправке кислородных масок, подушек и т.д. - в палатах со специальным микроклиматом - в палатах со специальным микроклиматом - для изготовления кислородных коктейлей - для изготовления кислородных коктейлей - при выращивании микроорганизмов - при выращивании микроорганизмов в экологии в экологии - при очистке питьевой воды - при очистке питьевой воды - при вторичной переработке металлов - при вторичной переработке металлов - при продувке сточных вод кислородом - при продувке сточных вод кислородом - при обезвреживании химически активных отходов в очистных установках в мусоросжигательных печах - при обезвреживании химически активных отходов в очистных установках в мусоросжигательных печах

Применение кислорода в химической промышленности в химической промышленности - при производстве ацетилена, целлюлозы, метилового спирта, аммиака, азотной и серной кислоты - при производстве ацетилена, целлюлозы, метилового спирта, аммиака, азотной и серной кислоты - при каталитической конверсии природного газа (при производстве синтетического аммиака) - при каталитической конверсии природного газа (при производстве синтетического аммиака) - при высокотемпературной конверсии метана - при высокотемпературной конверсии метана в энергетике в энергетике - при газификации твердого топлива - при газификации твердого топлива - для обогащения воздуха для бытовых и промышленных котлов - для обогащения воздуха для бытовых и промышленных котлов - для сжатия водно-угольной смеси - для сжатия водно-угольной смеси

Применение кислорода в военной технике в военной технике - в барокамерах - в барокамерах - для работы дизельных двигателей под водой - для работы дизельных двигателей под водой - в качестве окислителя топлива для ракетных двигателей - в качестве окислителя топлива для ракетных двигателей в сельском хозяйстве в сельском хозяйстве - для обогащения кислородом водной среды в рыболовстве - для обогащения кислородом водной среды в рыболовстве - при изготовлении кислородных коктейлей - при изготовлении кислородных коктейлей - для прибавки животных в весе - для прибавки животных в весе

ОЗОН Аллотропная модификация кислорода Озон О 3 - газ голубого цвета с резким запахом. Каждый, кто обратил внимание на то, как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо. Озон О 3 - газ голубого цвета с резким запахом. Каждый, кто обратил внимание на то, как пахнет воздух после грозы или вблизи источника электрического разряда, знает запах этого газа очень хорошо. В природе озон образуется под действием ультрафиолетового излучения Солнца, а также получается при электрических разрядах в атмосфере: В природе озон образуется под действием ультрафиолетового излучения Солнца, а также получается при электрических разрядах в атмосфере:

Озон - очень сильный окислитель, поэтому его используют при обеззараживании питьевой воды. При контакте с большинством способных окисляться веществ происходит взрыв. Озон образуется в атмосфере Земли на высоте 25 км под действием солнечной радиации, он поглощает опасное излучение Солнца. Однако в озоновом "зонтике" Земли, толщиной всего около 30 метров, то и дело возникают "дыры". В воздух попадает все больше "вредных" для озона газов, вроде монооксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью... Однако в озоновом "зонтике" Земли, толщиной всего около 30 метров, то и дело возникают "дыры". В воздух попадает все больше "вредных" для озона газов, вроде монооксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью...



Кислород
путешествие





Лавуазье Антуан Лоран
Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Положил начало опровержению теории флогистона. Получил кислород. Доказал сложный состав атмосферного воздуха, содержащего кислород и «удушливый воздух» (азот). Доказал сложный состав воды, установив, что она состоит из кислорода и водорода.

«Кислород – это вещество, вокруг которого вращается вся земная химия».
(Я.Берцелиус)
« Живые организмы пьют воздух для того,
чтобы напитаться кислородом».
(Д. И. Менделеев)
« Первая обязанность того, кто хочет стать здоровым - очистить вокруг себя воздух».
(Р.Ролан)

Что вы знаете о кислороде?
И что вы хотите узнать о нем?

Цель урока:
Какие ученые
работали
с кислородом?
Кислород
А что такое
катализатор?
История открытия
Способы получения
кислорода
Нахождение
в природе
Физические свойства

Цель урока:
- узнать значение кислорода
- узнать историю открытия кислорода
- узнать физические свойства кислорода
- научиться давать характеристику
кислороду как химическому элементу и
как простому веществу
- узнать о нахождении в природе
- узнать о получении кислорода.

«Историко-информационная»








- Он повсюду и везде: В земле, в воздухе, в воде. Он и в утренней росе, И в небес голубизне.






Общая характеристика
Химический знак - О
Порядковый номер - 8
Химическая формула - О 2
Молярная масса M (O 2) = 32г/моль
Валентность - II
Группа - 6 А
Период - 2

- Кислород – восьмой по счету, Если вес за меру взять. Если ж мера – место в жизни, Номер надо поменять.


- Газ без цвета, вкуса, запаха.
- Тяжелее воздуха: 1 литр при н. у. весит 1,43 г, а 1 л воздуха – 1,29 г.
- Плохо растворим в воде (рыбы дышат кислородом, растворенном в воде, в 100 л воды растворяется 5 л кислорода при температуре 0 градусов).
- t кипения = – 182,9 градусов.
- t плавления = – 218,8 градусов.


- 2 HgO = 2 Hg + O 2
- 2 H 2 O 2 = 2 H 2 O + O 2 (кат. MnO 2)
- 2 KClO 3 = 2 KCl + 3 O 2 (кат. MnO 2)
- 2 H 2 O = 2 H 2 + O 2
- 2 KNO 3 = 2 KNO 2 + O 2

2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2

Катализаторы – это вещества,
которые ускоряют химические реакции, но сами при этом
не расходуются.

- Умирал старый араб. Все его богатство состояло из 17 прекрасных верблюдов. Перед смертью он объявил сыновьям свою последнюю волю: «Мой старший сын, опора семьи, должен получить половину стада верблюдов, среднему я оставляю треть, а младшему – девятую часть стада». Сказал так и умер…

- Братья, похоронив отца, стали делить наследство. Но 17 не делится ни на 2, ни на 3, ни на 9.
- Помог им мудрец, подарив братьям своего верблюда. У них оказалось 18 животных.
- 18: 2 = 9,
- 18: 3 = 6,
- 18: 9 = 2.
- 9+6+2 = 17!
- Верблюд, подаренный ученым, сыграл роль катализатора.

Получение кислорода в промышленности
- Температура кипения азота -196ºС
- Температура кипения кислорода -183ºС
- Воздух
- Охлаждение до
- Жидкий кислород и газообразный азот
- Каким способом можно разделить смесь кислорода и азота?


Кислород
1 вариант.
- Химический знак кислорода: а) Н б) О в) К
- Относительная молекулярная масса кислорода равна: а) 16 б) 32 в) 48
- а) легче воздуха; б) плохо растворим в воде;
в) не поддерживает горение.
4. Название «Оxygenium» предложил:
5. Какие вещества образует химический элемент кислород? а) только простые вещества;
б) простые и сложные вещества;
в) только сложные вещества.
Ответы: 1 вариант – б, б, б, б, б.

Кислород
2 вариант.
- Формула молекулы кислорода: а) О 2 б) О в) О 3
- Относительная атомная масса кислорода равна: а) 16 б) 32 в) 48
- Кислород обладает следующими свойствами: а) тяжелее воздуха; б) хорошо растворим в воде; в) не поддерживает дыхание.
- Кислород в воде: а) малорастворим; б) хорошо растворим;
в) вообще не растворяется.
5. В 1774 году один учёный после проведённого эксперимента
написал: «Но что поразило меня больше всего – это то, что
свеча горела в этом воздухе удивительно блестящим
пламенем…» Это был: а) Пристли б) Лавуазье в) Шееле.
Ответы: 2 вариант – а, а, а, а, а.

- Ежегодно в результате фотосинтеза в атмосферу Земли поступает 3000 млрд. тонн кислорода.
- Основные поставщики кислорода – тропические леса и фитопланктон океана.
- Человек в сутки вдыхает примерно 750 литров кислорода.
- Полное прохождение атмосферного кислорода через систему биологического круговорота составляет 2000 лет!

Домашнее задание
§18, 19, 20 (физические свойства),
упр.1 - 3 (стр. 59).
- Напишите сказку о приключениях кислорода или сочинение "Чтобы я сделал для сохранения чистого воздуха на планете Земля?"

Урок №2
Кислород
путешествие
в «Мир удивительного вещества».

- «Опытно-экспериментальная».

Химические свойства кислорода.
I. Взаимодействие с неметаллами:
- М.В.Ломоносов определил, что кислород окисляет вещества, т.е. вступает в реакции окисления.
сера горит в кислороде.

II. Взаимодействие с металлами.
Горение железа в кислороде.
Горение кальция в кислороде.
3Fе + 2О 2 = Fе 3 О 4
2Ca + O 2 = 2CaO

- Что такое горение?
- Что общего выделялось в результате реакций горения?


- Что образуется в результате всех реакций?
- Оксиды.
Оксиды бывают разные Твердые, жидкие, газообразные. По-разному называются И свойствами отличаются. Но в одном они едины Их вместе называют - оксиды.

SO 2
Na 2 O
N 2 O 5
Fe 2 O 3


«Третий лишний».
Определите лишнее вещество. Ответ мотивируйте.
- СаО, СН 4 , N 2 О
- SiО 2 , О 2 , Н 2 О
- КОН, РвО, СО
- Al 2 О 3 , ZnО, HCl

«Найди соответствие».
- Найдите соответствие между формулой оксида и его названием. В своих тетрадях запишите к цифре соответствующую букву.
- 1) SО 3 а. оксид азота (IV)
- 2) ZnО b. оксид натрия
- 3) NО 2 с. оксид серы (VI)
- 4) SО 2 d. оксид цинка
- 5) Nа 2 О е. оксид серы (IV)

Правильно ли ты сделал?
- 1) SО 3 с. оксид серы (VI)
- 2) ZnО d. оксид цинка
- 3) NО 2 а. оксид азота (IV)
- 4) SО 2 е. оксид серы (IV) 5) Nа 2 О b. оксид натрия

Домашнее задание
§ 20 - 21, № 4 - 12, зад. № 1 - 3 (стр. 60);
подготовиться к практической
работе № 3, стр. 70.
Cлайд 1
Химия 8 класс 12.05.2008 * Учитель химии СОШ №33 «Норильская средняя общеобразовательная школа» Завалишина Елена НиколаеваCлайд 2
 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar = 16. 2. Строение атома: P11 = 8; n01 = 8; ē = 8 валентность II, степень окисления -2 (редко +2; +1; -1). 3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе. * *
1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar = 16. 2. Строение атома: P11 = 8; n01 = 8; ē = 8 валентность II, степень окисления -2 (редко +2; +1; -1). 3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе. * *
Cлайд 3
 4. В земной коре его 49% по массе, в гидросфере – 89% по массе. 5. В составе воздуха (в виде простого вещества) – 20-21% по объёму. Состав воздуха: О2 – 20-21 %; N2 – 78%; CO2 – 0,03%, остальное приходится на инертные газы, пары воды, примеси. * * Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры.
4. В земной коре его 49% по массе, в гидросфере – 89% по массе. 5. В составе воздуха (в виде простого вещества) – 20-21% по объёму. Состав воздуха: О2 – 20-21 %; N2 – 78%; CO2 – 0,03%, остальное приходится на инертные газы, пары воды, примеси. * * Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры.
Cлайд 4
 Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t кип= -183 С; t пл = -219 C; d по воздуху = 1,1. При давлении 760 мм. рт.ст. и температуре –183 С кислород сжижается * *
Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t кип= -183 С; t пл = -219 C; d по воздуху = 1,1. При давлении 760 мм. рт.ст. и температуре –183 С кислород сжижается * *
Cлайд 5
 С неметаллами C + O2 CO2 S + O2 SO2 2H2 + O2 2H2O * 5 Со сложными веществами 4FeS2 + 11O2 2Fe2O3 + 8SO2 2H2S + 3O2 2SO2 + 2H2O CH4 + 2O2 CO2 + 2H2O С металлами 2Mg + O2 2MgO 2Cu + O2 –t 2CuO Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель. 1. Неустойчив: O3 O2 + O 2. Сильный окислитель: 2KI + O3 + H2O 2KOH + I2 + O2 Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
С неметаллами C + O2 CO2 S + O2 SO2 2H2 + O2 2H2O * 5 Со сложными веществами 4FeS2 + 11O2 2Fe2O3 + 8SO2 2H2S + 3O2 2SO2 + 2H2O CH4 + 2O2 CO2 + 2H2O С металлами 2Mg + O2 2MgO 2Cu + O2 –t 2CuO Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель. 1. Неустойчив: O3 O2 + O 2. Сильный окислитель: 2KI + O3 + H2O 2KOH + I2 + O2 Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
Cлайд 6
 Промышленный способ (перегонка жидкого воздуха). Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2KClO3 –t ;MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2 Получение 3O2 2O3 Во время грозы (в природе), (в лаборатории) в озонаторе * 6
Промышленный способ (перегонка жидкого воздуха). Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2KClO3 –t ;MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2 Получение 3O2 2O3 Во время грозы (в природе), (в лаборатории) в озонаторе * 6
Cлайд 7
 перманганата калия при нагревании: 2KMnO4 –t K2MnO4 + MnO2 + O2 Разложение этой соли идёт при нагревании её выше 2000 С. Нагрев 2KMnO4 Проверка собравшегося кислорода * *
перманганата калия при нагревании: 2KMnO4 –t K2MnO4 + MnO2 + O2 Разложение этой соли идёт при нагревании её выше 2000 С. Нагрев 2KMnO4 Проверка собравшегося кислорода * *